Monosaccharide
Entdecke die Welt der Monosaccharide: Sie sind Einfachzucker und essentielle Bausteine von DNA und RNA. Sie zeichnen sich durch ihre Festigkeit, Farblosigkeit, Wasserlöslichkeit und Brennbarkeit aus. In Lebensmitteln findet man sie häufig, und sie liefern wertvolle Energie. Hier erfährst du, wie kein Zucker dem anderen gleicht!
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.


Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
Monosaccharide Übung
-
Beschreibe die Monosaccharide.
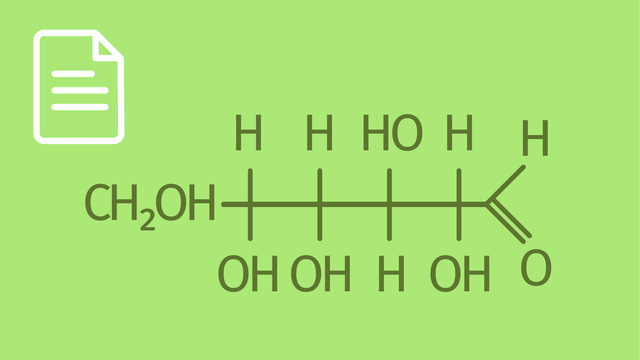
TippsLösungMonosaccharide sind Einfachzucker. Sie liegen am häufigsten in Ringform vor, können aber auch kettenförmig sein. Die Moleküle bestehen in der Mitte aus einem Kohlenstoffgerüst. An diesem befinden sich neben Wasserstoffatomen auch mehrere Hydroxid-Gruppen $\left(\ce{-OH} \right)$. Daher können Einfachzucker auch als Mehrfachalkohole bezeichnet werden. Sie können weiterhin als Aldehyde oder Ketone vorliegen. Dies ist abhängig von der im Molekül befindlichen funktionellen Gruppe. Ein Keton trägt eine Keto-Gruppe $\left(\ce{-C=O} \right)$ und ein Aldehyd eine Aldehyd-Gruppe $\left(\ce{-CHO} \right)$.
Monosaccharide sind fest, gut in Wasser lösbar und farblos. Die Löslichkeit in Wasser ist zum Beispiel wichtig für den Transport von Monosacchariden im Blut.
-
Gib die Einteilung der Monosaccharide wieder.
TippsIn einem Ring werden die Kohlenstoffatome nicht eingetragen. Jede Ecke steht für ein $\ce{C}$-Atom. Für andere Elemente wird das entsprechende Symbol eingetragen.
LösungUm Monosaccharide zu benennen, gibt es drei Möglichkeiten. Bei der ersten wird die Anzahl der $\ce{C}$-Atome bestimmt. Für diese Zahl wird ein entsprechendes Zahlwort an den Anfang des Namens gesetzt und mit -ose ergänzt. Für drei Kohlenstoffatome setzt man tri an den Anfang des Namens. Somit ergibt sich Triose als Lösung. Ein Zucker mit 4 $\ce{C}$-Atomen nennt man Tetrose, mit 5 $\ce{C}$-Atomen Pentose und mit 6 $\ce{C}$-Atomen Hexose. Glucose, Fructose oder Galactose währen ein Beispiel für eine Hexose.
Bei der zweiten Methode nutzt man die funktionellen Gruppen. Aldehyde besitzen die Aldehyd-Gruppe. Sie muss am Ende einer Kohlenstoffkette stehen. Der Grund hierfür liegt in der Vierbindigkeit des Kohlenstoffatoms. Am $\ce{C}$-Atom der Gruppe sitzt ein $\ce{H}$-Atom und ein $\ce{O}$-Atom ist mit diesem über eine Doppelbindung verbunden. Somit kann das $\ce{C}$-Atom nur noch eine Bindung eingehen, und zwar zu einem anderen Kohlenstoffatom. Trägt ein Monosaccharid diese Gruppe, so nennt man es Aldose. Die Keto-Gruppe gibt den Ketosen ihren Namen. Sie setzt sich zusammen aus einem $\ce{C}$-Atom und einem $\ce{O}$-Atom, das über eine Doppelbindung mit ersterem verbunden ist. Keto-Gruppen stehen nicht am Anfang/Ende einer Kohlenstoffkette, sondern innerhalb dieser.
Die Ringe der Monosaccharide werden in der letzten Methode betrachtet. In einem Sechsring kann man 6 Ecken zählen. Dabei sind fünf von diesen mit $\ce{C}$-Atomen besetzt und eine mit einem $\ce{O}$-Atom. Einen solchen Zucker nennt man Pyranose. Ein Fünfring hat 5 Ecken, von denen 4 mit $\ce{C}$-Atomen besetzt sind und eine mit einem $\ce{O}$-Atom besetzt ist. Diese Zucker nennt man Furanose. In den Ringen müssen die Kohlenstoffatome in den Ecken und ihre dazugehörigen Wasserstoffatome nicht geschrieben werden. Nur andere Atome, wie Sauerstoff oder Stickstoff, werden entsprechend eingetragen.
-
Erarbeite die Namen der Monosaccharide.
TippsDas Zahlwort für 3 ist tri.
Monosaccharide tragen im letzten Namensteil immer die Endung -ose.
LösungIn Bild 1 ist die Anzahl ($n$) der Kohlenstoffatome dargestellt. Die Methode der Einteilung der Einfachzucker verläuft nach Zahl der Kohlenstoffatome. Verbindung 1 soll 6 $\ce{C}$-Atome besitzen. Das Zahlwort dazu lautet „hex“. Hängt man nun noch die Endung -ose heran, dann erhält man den Namen des Zuckers: Hexose. Die zweite Verbindung hat 8 $\ce{C}$-Atome. Hierzu lautet das Zahlwort "oct". Mit der Endung -ose ergibt sich auch hier der Name des Einfachzuckers: Octose.
Die Moleküle in Bild 2 unterschieden sich in der Anzahl der $\ce{C}$-Atome und in den funktionellen Gruppen. Somit kommt hier die Methode nach funktionellen Gruppen zur Anwendung. In Verbindung (a) sitzt die Gruppe am Ende der Kohlenstoffkette. Weiterhin besteht diese Gruppe aus einem $\ce{C}$-, einem $\ce{H}$- und einem $\ce{O}$-Atom. Es handelt sich also um eine Aldehyd-Gruppe und das Monosaccharid ist eine Aldose. Verbindung (b) trägt die funktionelle Gruppe innerhalb der Kohlenstoffkette. Sie besteht aus einem $\ce{C}$- und einem $\ce{O}$-Atom. Da dies die Keto-Gruppe ist, nennt sich der Einfachzucker Ketose.
-
Erkläre die Seliwanow-Probe mit Hilfe von Reaktionsgleichungen.
TippsNutze die unvollständigen Wortgleichungen, um einige Edukte und Produkte zu enthalten.
Es ist richtig ausgeglichen, wenn auf beiden Seiten des Reaktionspfeils die gleiche Anzahl der jeweiligen Atome steht.
Nutze falls nötig einen Notizzettel beim Zählen der Atome.
LösungAus der ersten Wortgleichung ist das Edukt und eines der Produkte zu entnehmen. Die Ketose ist in diesem Fall unsere Fructose mit der Summenformel $\ce{C6H12O6}$. Das erste Produkt ist bereits vorgegeben als $\ce{C6H6O3}$. Auf den ersten Blick ist zu erkennen, dass die Anzahl der $\ce{C}$-Atome gleich ist. Jedoch fehlen auf Seiten der Produkte $\ce{6 H}$-Atome und $\ce{3 O}$-Atome. Mit Hilfe dieser Zahlen und der Wortgleichung (es wird Wasser abgespalten) ergibt sich die Lösung: $\ce{3 H2O}$.
Bei der zweiten Teilreaktion soll das Produkt von eben mit Sauerstoff $\left( \ce{O2} \right)$ und Resorcin weiter reagieren. Die Summenformel von letzterem ist dabei bereits vorgegeben und die Summenformel des Produktes aus Gleichung 1 hat die Formel $\ce{C6H6O3}$. Eines der Produkte der zweiten Reaktion ist bereits angegeben: der rote Farbstoff $\left( \ce{C18H12O5} \right)$. Als weiteres Produkt entsteht Wasser $\left( \ce{H2O} \right)$. Um zu wissen, wie viel $\text{mol}$ davon entstehen, betrachten wir die Anzahl an $\ce{O}$- und $\ce{H}$-Atomen. Dabei muss bedacht werden, dass die noch unklar ist, wie viel $\text{mol}$ Sauerstoff an der Reaktion beteiligt sind. Somit muss die Menge an Wasser mit Hilfe der Wasserstoffatome bestimmt werden. Links vom Reaktionspfeil sind $18$ Atome zu zählen und rechts $12$. Daraus ergibt sich eine Differenz von $6$ Atomen. Ein Wassermolekül hat $\ce{2 H}$-Atome. Folglich entstehen $3\,\text{mol}$ Wasser $\left( \ce{3 H2O} \right)$. Nun kann die Menge an Sauerstoff auf Seiten der Edukte bestimmt werden. Rechts vom Reaktionspfeil sind $\ce{8 O}$-Atome und links $7$, womit sich eine Differenz von $1$ ergibt. Da Sauerstoff zweiatomig vorliegt, muss die Differenz durch zwei geteilt werden. Die Lösung ist somit $0{,}5\,\ce{O2}$.
-
Erkenne, in welchen Lebensmittel folgende Saccharide enthalten sind.
TippsIn Stärke finden sich Polysaccharide.
LösungMonosaccharide sind Einfachzucker. Zu ihnen gehören zum Beispiel Glucose, Fructose und Galactose. Glucose und Galactose haben eine besondere Wirkung auf den menschlichen Körper: Sie sorgen für einen direkten Anstieg des Blutzuckerspiegels. Disaccharide sind Zweifachzucker. Der wirtschaftlich wichtigste Vertreter ist die Saccharose (Rohr- und Rübenzucker). Mono- und Disaccharide sind enthalten in Früchten (Erdbeeren, Äpfeln, Bananen,...), in Honig und in vielen Süßigkeiten (Bonbons, Kuchen, Lollipops,...). Empfohlen wird eine tägliche Aufnahme dieser Zucker von unter $10\,\%$.
Neben Stärke sind auch Pektine und Cellulose Beispiele für Polysaccharide. Sie setzten sich zusammen aus mehreren Monosacchariden. Polysaccharide sind in Kartoffeln, Mais oder Reis enthalten. Mindestens $90\,\%$ der täglichen Nahrung sollen diese Zucker ausmachen.
-
Erarbeite die Reaktionsgleichungen für den Nachweis von Glucose.
TippsEs ist richtig ausgeglichen, wenn auf beiden Seiten des Reaktionspfeils die jeweils gleiche Anzahl der Atome steht.
LösungBei der ersten Reaktion entsteht ein rot-brauner Niederschlag. Der Glucose-Nachweis erfolgt hier also mittels Fehling-Reagenz. Die ersten Lücken bei der Reaktionsgleichung der Oxidation lassen sich mithilfe des dazugehörigen Satzes füllen. Zu den Edukten gehört eine Verbindung mit einer Aldehyd-Gruppe. In diesem Fall ist es die Glucose, welche in abgekürzter Schreibweise eingetragen werden muss: $\ce{R-CHO}$. Wird diese funktionelle Gruppe oxidiert, dann entsteht eine Carbonsäure. Als ein Produkt muss also $\ce{R-COOH}$ eingetragen werden. Vergleicht man nun die Anzahl der Atome auf Produkt- und Eduktseite, dann fällt auf, dass auf Seiten der Produkte zwei $\ce{H}$- und ein $\ce{O}$-Atom fehlen. Es muss sich somit als drittes Produkt Wasser $\left( \ce{H2O} \right)$ bilden.
Die in der ersten Reaktion gebildeten Elektronen kommen bei der Reduktion zum Einsatz. Sie reagieren mit $\ce{2 Cu^{2+}}$ und Hydroxidionen. Das dabei entstehende Produkt <nobr>Kupfer(I)-hydroxid</nobr> hat die Summenformel $\ce{CuOH}$. Links vom Reaktionspfeil befinden sich allerdings zwei Kupferionen. Damit auf beiden Seiten gleich viele $\ce{Cu}$-Atome stehen, muss als Lösung $\ce{2 CuOH}$ eingetragen werden. Auf der Produktseite befinden sich nun zwei $\ce{O}$- und zwei $\ce{H}$-Atome. Somit müssen $2\,\text{mol}$ Hydroxidionen $\left( \ce{2 OH^-} \right)$ als Edukt eingesetzt werden. Das im letzten Schritt gebildete <nobr>Kupfer(I)-oxid</nobr> besitzt die Summenformel $\ce{Cu2O}$. Da hier zwei Kupferatome enthalten sind, müssen auf der Eduktseite ebenfalls zwei Kupferatome stehen. Die richtige Lösung ist somit $\ce{2 CuOH}$.
Beim zweiten Nachweis bildet sich ein Silberspiegel aus. Daher kommt hier das Tollens-Reagenz zur Anwendung. Im ersten Schritt wird die Aldehyd-Gruppe erneut zur Carboxyl-Gruppe oxidiert. Als Lösung bei den Produkten muss somit $\ce{R-COOH}$ in die Lücke eingesetzt werden. Als Edukt müssen auch bei dieser Oxidationsreaktion Hydroxidionen eingetragen werden. Um festzustellen, wie viele Mol benötigt werden, zählt man die $\ce{H}$- und $\ce{O}$-Atome auf beiden Seiten des Reaktionspfeils. Rechts sind je $3$ Atome zu zählen und links je $1$ Atom. Es müssen somit $\ce{2 OH^-}$ als Lösung auf der Eduktseite eingetragen werden.
Durch die anschließende Reduktion bildet sich der Silberspiegel, d. h. es bildet sich Silber $\left( \ce{Ag} \right)$. Bei der Reduktion kommt es zur Aufnahme von Elektronen. Somit sind Silberionen die Edukte dieser Reaktion. Da zwei Elektronen in der Oxidation gebildet wurden und Silberionen $\left( \ce{Ag^+} \right)$ die Ladung $1+$ tragen, muss als Lösung auf der Eduktseite $\ce{2 Ag^+}$ eingesetzt werden. Damit ergeben sich als Produkt $2\,\text{mol}$ Silber $\left( \ce{2 Ag} \right)$.
9.360
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.211
Lernvideos
38.688
Übungen
33.496
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen













