Nachweis von Kohlenhydraten


in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Nachweis von Kohlenhydraten
In diesem Video werden dir die gängigsten Nachweisreaktionen für Kohlenhydrate vorgestellt und beschrieben. Vor allem Mono- und Disaccharide lassen sich mit den Nachweisen feststellen, aber auch Polysaccharide nachdem man diese hydrolysiert hat. Im Wesentlichen zielen alle hier gezeigten Nachweise (Molisch-Probe, Fehling-Probe, Tollens-Probe, Benedict-Reagenz) auf die Reduktion durch den Zucker ab, wobei die Nachweise unterschiedlich sensibel sind. Die Ausnahme hiervon bildet die Seliwanow-Probe, welche spezifisch Fructose nachweist. Wenn du mehr dazu erfahren willst, dann schau dir das Video an.
Transkript Nachweis von Kohlenhydraten
Guten Tag und herzlich willkommen! Dieses Video heißt: Nachweis von Kohlenhydraten. Der Film gehört zur Reihe Kohlenhydrate. Für die Vorkenntnisse solltest du möglichst viele Videos über Kohlenhydrate bereits gesehen haben. Mein Ziel ist es, dir in diesem Video einen Einblick in schnelle und einfache Kohlenhydratnachweise zu geben. Der Film ist wie folgt gegliedert: 1. Umfang des Videos 2. Molisch-Probe 3. Fehling-Probe 4. Tollens-Probe 5. Benedict-Reagenz 6. Seliwanow-Probe 7. Übersicht 8. Zusammenfassung 1. Umfang des Videos: Im Video möchte ich nur schnelle, zuverlässige Verfahren vorstellen. Das Vorhandensein von Kohlenhydraten wird jeweils durch klare Farben angezeigt. Wir werden im Video nur die Nachweise von Monosacchariden und Disacchariden betreiben. Auch Polysaccharide können ähnlich nachgewiesen werden, nachdem sie einer Hydrolyse unterzogen wurden. Zwei Analyseprinzipien möchte ich nennen: Wir haben gelernt, dass Ring und Kette vor allem in wässriger Lösung ein Gleichgewicht bilden. Von der Kette haben wir weniger, doch das reicht uns, für unsere Analyse. Entscheidend für unsere Nachweise ist fast in allen Fällen das Vorhandensein der Aldehydgruppe. Ist eine Aldehydgruppe vorhanden, so wirkt der Zucker reduzierend, und der Nachweis erfolgt positiv. 2. Molisch-Probe: Die Molisch-Probe dient zum Nachweis aller Kohlenhydrate. Gegebenenfalls erfolgt als Vorstufe eine Hydrolyse. Das Molisch-Reagenz besteht hauptsächlich aus Alpha-Naphtol, das ist ein Naphtalinderivat, dass die Hydroxygruppe in der angegebenen Stellung enthält. Als weitere Komponente benötigt man Schwefelsäure. Die Kohlenhydrate werden verdünnt in wässriger Lösung untersucht. Die Molisch-Probe zeigt Kohlenhydrate als violetten Farbstoff an. Wichtig ist zu merken, die Reaktion gilt für alle Kohlenhydrate. 3. Fehling-Probe: Das Fehling-Reagenz besteht aus zwei Komponenten. Fehling I enthält Kupfersulfat. Kupfersulfatlösung ist blau. Fehling II enthält in wässriger Lösung ein Doppelsalz der Weinsäure. Das ist Kaliumnatriumtartrat. Die Formelgleichung sieht so aus: Die Aldehydgruppe des Zuckers reagiert mit zwei Kupfer2-Ionen und vier Hydroxid-Ionen. Diese werden durch eine Base, zum Beispiel Natriumhydroxid, geliefert. Die Base steckt schon vorbereitet in Fehling II. Der Aldehyd wird zur Karbonsäure oxidiert. Die Kupfer2-Ionen werden zum roten Kupfer1-Oxid reduziert. Außerdem wird Wasser frei. So sieht das Ergebnis rechts im Reagenzglas aus. Fast alle Zucker können so nachgewiesen werden. Eine Ausnahme ist Saccharose. Im Basischen wandelt sich Fructose, eine Ketose, in die Aldose Glucose um, und wird so indirekt auch nachgewiesen. 4. Tollens-Probe: In der Tollens-Probe sind folgende Komponenten enthalten: ...Habt ihr sie erkannt? Richtig, es handelt sich um ammoniakalische Silbernitratlösungen. In Formelschreibweise reagiert der Aldehyd des Zuckers mit zwei Silber-Ionen und zwei Hydroxy-Ionen. Der Aldehyd wird zur Karbonsäure oxidiert. Es bildet sich elementares Silber und Wasser. Das Silber bildet den Silberspiegel. Fast alle Zucker können so nachgewiesen werden. Ausnahmen sind Saccharose, und wenn man vorsichtig arbeitet, auch Fructose. Bei Zusatz einer starken Base wandelt sich die Fructose in Glucose um, und es entsteht auch ein Silberspiegel. 5. Benedict-Reagenz: Das Benedict-Reagenz besteht hauptsächlich aus dem Natriumsalz dieser Säure. Es ist die Zitronensäure. Das Salz heißt Natriumcitrat. Außerdem enthält das Benedict-Reagenz Kupfersulfat und Natriumkarbonat. Kupfersulfat, kennen wir von der Fehling-Probe, ist blau. Ein Molekül des Aldehyds reagiert nun mit zwei Kupfer2-Ionen und vier Hydroxy-Ionen, die das Natriumkarbonat in wässriger Lösung bildet. Der Aldehyd wird zur Karbonsäure oxidiert. Die Bildung von Kupfer1-Oxid erkennt man an der roten Farbe. Außerdem entsteht Wasser. Die blaue Farbe verschwindet und es entsteht rotes Kupfer1-Oxid. Die Reaktion läuft ähnlich zur Fehling-Probe ab. Fast alle Zucker reagieren, nur Saccharose nicht. 6. Seliwanow-Reaktion: Die Hauptkomponente des Seliwanow-Reagenzes ist Resorcin, ein Diphenol. Als zweite Komponente benötigt man konzentrierte Salzsäure. Nun wird vorsichtig und nicht zu lange, nicht mehr als 1 Minute, erwärmt. Die Seliwanow-Probe erweist sich als selektives Reagenz auf Fructose. Erwärmt man länger, etwa 5 Minuten, so kann man mit dieser Probe die schöne rote Farbe auch für Glucose und Saccharose erzielen. Daher immer schön vorsichtig sein und nicht zu lange erwärmen. 7. Übersicht: Die Ergebnisse des Videos möchte ich in einer Übersicht zusammenstellen. Folgende Zucker stehen im Kopf: Die Monosaccharide Glucose, Fructose, Galactose und die Disaccharide Maltose, Celubiose, Lactose und Saccharose. Die Nachweismethoden kürze ich mit einem Buchstaben ab. Molisch, Fehling, Tollens, Benedict und Seliwanow: Die Molisch-Probe ist ein universelles Verfahren. Alle Mono- und Disaccharide zeigen eine positive Reaktion. Auch bei der Fehling-Probe reagieren alle Zucker, bis auf den nicht-reduzierenden Zucker Saccharose. Bei Tollens sieht es ähnlich aus. Wenn man sehr vorsichtig arbeitet, reagiert auch Fructose nicht. Aber ganz verlassen würde ich mich darauf nicht. Die Benedict-Probe ist eine gute Alternative zur Fehlingschen Probe und zeigt daher auch die gleichen Ergebnisse. Ein herausragendes Verfahren ist die Seliwanow-Probe. Wenn man vorsichtig arbeitet kann man Fructose spezifisch nachweisen. 8. Zusammenfassung: 1. Nachgewiesen werden Monosaccharide und Disaccharide. Um Polysaccharide zu untersuchen, müssen sie vorher hydrolisiert werden. 2. Die Molisch-Probe ist ein universeller Zucker-Nachweis. 3. Durch die Proben nach Fehling, Tollens und Benedict werden fast alle Zucker nachgewiesen. Eine der Ausnahmen ist Saccharose. 4. Mit der Seliwanow-Probe, richtig durchgeführt, wird spezifisch Fructose nachgewiesen. Ich danke für die Aufmerksamkeit. Alles gute, auf Wiedersehen!
Nachweis von Kohlenhydraten Übung
-
Erkläre die Tollens-Probe.
TippsDie Tollens-Probe trägt universalen Charakter.
Entscheidend ist die Anwesenheit einer bestimmten funktionellen Gruppe.
Es handelt sich um eine Redoxreaktion.
Lösung1. Die Tollens-Probe
Die Tollens-Probe ist ein universelles Verfahren zum Nachweis von Zuckern. Mit dieser Methode können viele Monosaccharide nachgewiesen werden. Es ist daher legitim zu sagen, dass fast alle Zucker erfasst werden. Das Reagenz beinhaltet als Hauptkomponente eine Silbernitrat-Lösung. Das Salz Silbernitrat ist für den Nachweis in zweifacher Hinsicht wertvoll:- Es handelt sich um eines der wenigen sehr gut löslichen Salze des Silbers.
- Silber ist ein edles Metall und seine Ionen daher sehr gut reduzierbar.
$NH_3\;+\;H_2O\;\longrightarrow\;NH_4^\oplus\;+\;OH^\ominus$
2. Die allgemeine Reaktionsgleichung
$R-CHO\;+\;2\:Ag^\oplus\;+\;2\:OH^\ominus\;\rightarrow\;R-COOH\;+\;2\:Ag\downarrow\;+\;H_2O$
Man sieht, dass man die Tollens-Probe für den Nachweis von Aldehyden verwenden kann. Allgemein und natürlich auch beim Zucker bildet sich eine Carboxy-Gruppe. Für die Reduktion der Silber-Ionen benötigt man Hydroxid-Ionen. Wir haben bereits gesehen, dass diese vom Ammoniak geliefert werden.
3. Der Nachweis als Redoxreaktion
Beim organischen Edukt handelt es sich immer um einen reduzierenden Zucker. Beim Nachweis nach Tollens wird dieser oxidiert. Die Silber-Ionen als Ionen eines edlen Metalls werden leicht reduziert. Offensichtlich ist die Tollens-Probe ein Nachweis für Aldehyde. Ketone haben zwar generell ähnliche Eigenschaften, sie sind aber schwerer zu reduzieren. Die Probe ist kein Nachweis für Carbonsäuren, da diese ja gerade das Hauptprodukt der Reaktion sind. -
Erkläre die Fehling-Probe.
TippsDie Fehling-Probe ist eine Redoxreaktion.
Eine bestimmte funktionelle Gruppe wird nachgewiesen.
Der Ursprung der Sauerstoffatome, die bei der Reaktion oxidieren, ist aus der Reaktionsgleichung ersichtlich.
Lösung1. Das Fehling-Reagenz
Wie bei der Tollens-Probe können mit der Fehling-Probe fast alle Zucker nachgewiesen werden. Die beiden Komponenten des Reagenzes sind:- Fehling I: Kupfersulfat-Lösung
- Fehling II: Kaliumnatriumtartrat
2. Reaktion
Die allgemeine Reaktionsgleichung lautet:$R-CHO$$\;+\;$$2\:Cu^{2\oplus}$$\;+\;$$4\:OH^-$$\;\longrightarrow\;$$R-COOH$$\;+\;$$Cu_2O\downarrow$$\;+\;$$2\:H_2O$
Da Hydroxid-Ionen an der Reaktion beteiligt sind und im Überschuss vorliegen sollten, ist der pH-Wert des Analysegemisches größer als 7. Im Gegensatz zur Tollens-Probe entsteht kein metallisches Kupfer. Mit bloßem Auge ist das aber kaum festzustellen, denn das ausfallende Kupfer(I)-oxid ist wie Kupfer von roter (bzw. rötlicher) Farbe.
3. Die Fehlung-Probe als Redoxreaktion
Das organische Edukt ist ein Aldehyd. Aldehyde sind leicht oxidierbar. Daher wird das Edukt oxidiert. Bei der Oxidation schiebt sich ein Sauerstoffatom in die C-H-Bindung der Aldehyd-Gruppe. Die Reaktionsgleichung zeigt, dass das Sauerstoffatom seinen Ursprung in einem Hydroxid-Ion hat. Dieses aber wird durch die anwesende Base im Ergebnis der Dissoziation gebildet. -
Bestimme die Kohlenhydrate, die einen Silberspiegel liefern.
TippsDer Zucker muss reduzierend sein.
Reduzierend ist ein Zucker, wenn er eine bestimmte funktionelle Gruppe enthält.
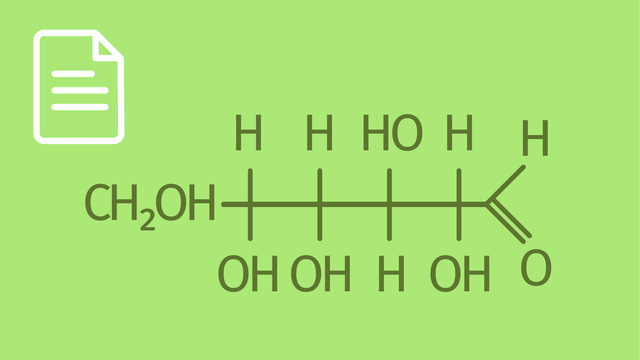
LösungErste Reihe: Fructose wird nachgewiesen, denn es enthält eine Aldehyd-Gruppe. Saccharose enthält keine Adehyd-Gruppe. Glucose in der Ringform enthält keine Aldehyd-Gruppe. Eine reduzierende Aldehyd-Gruppe gibt es aber in der Kettenform.
Zweite Reihe: Galactose wird nachgewiesen, denn es enthält eine Aldehyd-Gruppe. Für Cellulose und Xylit trifft das nicht zu.
Dritte Reihe: Maltose und Ribulose wirken nicht reduzierend. Desoxyribose hingegen ist eine Aldose und kann somit mit der Tollens-Probe (Silberspiegel) nachgewiesen werden.
-
Ermittle die Gemeinsamkeiten und Unterschiede der Nachweise nach Fehling und Tollens.
TippsÜberlege, was sich bei den Proben nach Tollens und Fehling jeweils bildet.
Kupfer(II)-hydroxid ist das Farbpigment Bremer Blau oder Bremer Grün.
LösungBei der Tollens-Probe wird das Reagenz vollständig reduziert. Aus den Silber-Ionen bildet sich metallisches Silber. Entsprechend wird bei der Fehling-Probe das Reagenz nur teilweise reduziert. Aus den Kupfer(II)-Ionen entstehen Kupfer(I)-Ionen, die man im roten Kupfer(I)-oxid findet.
Die Tollens-Probe läuft nicht im stark basischen Milieu ab. Die Anwesenheit von Ammoniak führt zu schwach basischen Bedingungen. Entsprechend läuft die Fehling-Probe nicht im schwach basischen Milieu ab. Die Anwesenheit von Natriumhydroxid schafft stark basische Bedingungen.
Beim Tollens-Reagenz verhindert der pH-Wert tatsächlich den Nachweis von Fructose. Die Konzentration der Hydroxid-Ionen ist für eine Umwandlung der Fructose zur reduzierenden Glucose zu gering. Entsprechend bewirkt der hohe pH-Wert beim Fehling-Reagenz eine Umwandlung von Fructose zu Glucose.
Tollens-Reagenz und/oder Fehling-Reagenz können nicht alle Monosaccharide nachweisen. Das gelingt nur bei ihren reduzierenden Vertretern.
Sowohl das Tollens-Reagenz als auch das Fehling-Reagenz verlangen das Vorliegen der Kettenform des Moleküls. Das ist eine notwendige Bedingung.
Fehling II (Kaliumnatriumtartrat) verhindert tatsächlich ein Ausfallen der Kupfer(II)-Ionen in den Niederschlag. Unter den kräftigen basischen Bedingungen würde sich anderenfalls sofort praktisch unlösliches Kupfer(II)-hydroxid bilden. Der Nachweis reduzierender Zucker wäre dann unmöglich.
-
Nenne die Nachweisverfahren zu folgenden Nachweiseffekten bei Kohlenhydratnachweisen.
TippsDie Farben der Nachweise sind ganz charakteristisch.
LösungMolisch-Probe – Bildung eines violetten Farbstoffs
Es wird ein konjugiertes Molekül synthetisiert. Das ist ein Molekül, bei dem sich Einfachbindungen und Doppelbindungen fortlaufend abwechseln. Dadurch entsteht eine farbige Verbindung.
Fehling-Probe – Bildung eines roten Feststoffs
Die Reaktionen ist eine Redoxreaktionen. Das Wesen der Reaktion ist die Reduktion.
$Cu^{2+}$$\;\longrightarrow\;$$Cu^{+}$$\;+\;e^-$
Die Kupfer(II)-Ionen werden zu Kupfer(I)-Ionen reduziert. Es entsteht Kupfer(I)-oxid $Cu_2O$, das wir als roten Stoff erkennen.
Tollens-Probe– Bildung eines Silberspiegels
Silber(I)-Ionen werden reduziert. Sie fallen als metallisches Silber aus und bilden den Spiegel.
Seliwanow-Probe – rotbrauner Farbstoff
Beim vorsichtigen Erwärmen wird der Nachweis für Glucose erbracht. Erwärmt man intensiver, kann man Fructose und sogar Saccharose nachweisen.
-
Erkläre die einzelnen Reaktionsschritte der Molisch-Probe.
TippsDas Schema der Reaktion ist dir eine Hilfe.
p-Orbitale in konjugierten Systemen überlappen und es kommt zu einer starken Elektronenbewegung über das gesamte molekulare System.
Lösung1. Schritt
Bei dem nachzuweisenden Zucker handelt es sich um D-Glucose. Auf das Molekül der D-Glucose wirken Oxonium-Ionen ein. Mitunter nennt man sie auch Hydronium-Ionen. Bei der Reaktion eines dieser Teilchen entstehen drei Moleküle Wasser.
Im Molekül des Produkts erkennt man die aromatische Verbindung Furan. Die funktionelle Gruppe $OH-$ bedeutet, dass es sich auch um einen Alkohol handelt. Die funktionelle Gruppe $-CHO$ zeigt einen Aldehyd an. Das entstandene Produkt trägt den systematischen Namen 5-Hydroxymethylfurfural.
2. Schritt
Im zweiten Schritt findet eine Reaktion mit zwei Molekülen $\alpha$-Naphthol statt. Dabei findet zunächst eine Kondensationsreaktion statt. Durch Oxidation entsteht ein Kation.
3. Schritt
Man erhält ein konjugiertes System. Das bedeutet, dass sich Einfachbindungen und Doppelbindungen fortlaufend abwechseln. Die vielen $\pi$-Elektronen und ihre starke Delokalisierung bewirken eine geringe energetische Differenz zwischen dem höchsten bindenden Molekülorbital (HOMO) und dem niedrigsten antibindenden Molekülorbital (LUMO). Dieser Effekt kommt dadurch zustande, dass den Orbitalen energetisch nach unten wie oben Grenzen auferlegt sind. Somit werden sie im Inneren (energetisch!) zusammengedrückt. Der sogenannte HOMO-LUMO-Gap erfährt eine Verminderung. Es ist eine Absorption sichtbaren Lichtes möglich. Sie entfällt auf den gelben Betrag des weißen Lichtes. Die komplementäre Farbe (violett) sehen wir. Sie dient zum Nachweis des Zuckers.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9.802
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.302
Lernvideos
38.655
Übungen
33.694
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?









Du hast völlig recht. Ich habe die Seliwanow - Reaktion vielfach an verschiedenen Zuckern ausprobiert. Der Punkt ist, dass man vorsichtig arbeiten muss. Das bedeutet, man darf nur eine bis höchstens zwei Minuten erwärmen. Drei Minuten ist schon kritisch. Nach fünf Minuten ist die Probe auf Saccarose positiv. Reine Fructose kann dagegen schon nach 1 - 2 Minuten nachgewiesen werden.
Alles Gute und viel Erfolg morgen in der Klausur
hallo , ich schreibe morgen eine klausur zum thema kohlenhydrate. Warum reagiert die seliwanow (resorcin probe) negativ bei saccharose, sollte die salzsäure (da säure) nicht die glykosidische bindung zwischen dem c1 der glucose und dem c2 der fructose spalten ? sodass dann ein frei verfügbares fructosemolekül nachgewiesen sollte ?