Versterung und Esterverseifung
- Wiederholung – die Veresterung
- Die Veresterung allgemein formuliert
- Die Veresterung von Glycerin mit Fettsäuren
- Eigenschaften der Ester
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Lerntext zum Thema Versterung und Esterverseifung
Wiederholung – die Veresterung
Die Veresterung allgemein formuliert
Reagiert eine Säure mit Alkohol, entsteht ein Ester.
Die Säure kann sowohl organisch als auch anorganisch sein. Hier betrachten wir die Reaktion von organischen Säuren, also den Carbonsäuren.
Die Veresterung von Carbonsäuren mit Alkoholen ist eine Kondensationsreaktion. Eine Kondensationsreaktion ist eine chemische Reaktion, bei der Wasser abgespalten wird.
Die allgemeine Reaktionsgleichung der Veresterung lautet:
Der Buchstabe $\ce{R}$ steht hier für einen beliebigen Alkylrest, wobei $\ce{R^{1}}$ und $\ce{R^{2}}$ sich unterscheiden, aber auch gleich sein können.
Die Veresterung ist eine sehr langsam verlaufende Reaktion. Durch den Einsatz von Katalysatoren, in diesem Fall Säuren, wird die Reaktionsgeschwindigkeit aber stark erhöht. Daher handelt es sich bei der Veresterung um eine säurekatalysierte Reaktion.
Die Rolle der Säure wird im Reaktionsmechanismus deutlich.
- Im ersten Schritt findet die Protonierung statt. Das Proton $\ce{H+}$ entstammt einer Säure und bindet sich an das Sauerstoffatom der Carboxygruppe der Carbonsäure 1. Dabei klappen die Elektronen der $\ce{C-O}$-Doppelbindung zum Sauerstoffatom um. Es entsteht ein positiv geladenes Kohlenstoffatom, das Carbokation 2.
- Dann greift das nucleophile Sauerstoffatom des Alkohols das Carbokation 2 an. Die positive Ladung verschiebt sich zum Sauerstoffatom 3.
- Das am positiv geladenen Sauerstoffatom benachbarte Wasserstoffatom wird vom Sauerstoffatom der Hydroxygruppe angegriffen. Es findet eine Protonenwanderung statt.
- Die $\ce{C-O}$-Bindung löst sich, sodass Wasser abgespalten, also eliminiert, wird. Es entsteht wieder ein Carbokation 4. Die Elektronen am Sauerstoffatom verschieben sich erneut, sodass wieder eine $\ce{C-O}$-Doppelbindung entsteht. Die positive Ladung wandert vom Kohlenstoffatom 4 zum Sauerstoffatom 5.
- Das Bindungselektronenpaar zwischen dem Sauerstoffatom und dem Wasserstoffatom verschiebt sich zum Sauerstoffatom. Durch die daraus folgende Abspaltung des Protons $\ce{H+}$, also die Deprotonierung, entsteht der Carbonsäureester 6.
Das zu Beginn eingesetzte Proton $\ce{H+}$ ist am Ende der Reaktion wieder frei. Das ist typisch für Katalysatoren. Eine Eigenschaft von Katalysatoren ist nämlich, dass sie nicht verbraucht werden.
Die Veresterung von Glycerin mit Fettsäuren
Die Moleküle von natürlichen Fetten und Ölen sind Ester. Genauer gesagt handelt es sich bei Fettmolekülen um Fettsäureglycerinester.
Fettsäureglycerinester entstehen durch die Veresterung von Glycerin mit Fettsäuren unter Abspaltung von bis zu drei Wassermolekülen. Fettsäuren sind langkettige Carbonsäuren mit einer Carboxygruppe. Glycerin ist ein dreiwertiger Alkohol. Es besitzt drei Hydroxygruppen.
Bei der Veresterung von Glycerin mit Fettsäuren können daher bis zu drei verschiedene Fettsäuren mit Glycerin reagieren.
Die allgemeine Reaktionsgleichung der Veresterung von Glycerin mit Fettsäuren lautet:
Sind alle drei Hydroxygruppen des Glycerins zum Ester reagiert, dann spricht man von einem Triglycerid.
Eigenschaften der Ester
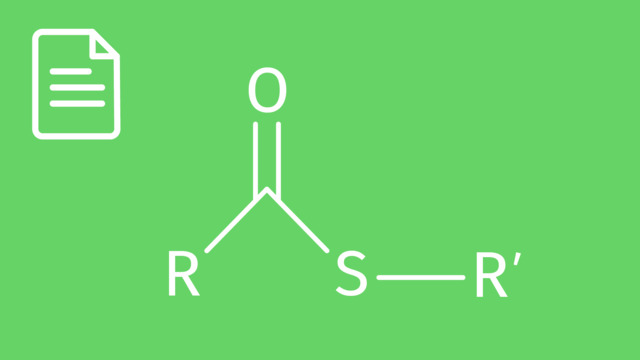
Die funktionelle Gruppe der Carbonsäureester besteht aus einer $\ce{C-O}$-Doppelbindung, also einer Ketogruppe und einem weiteren Sauerstoffatom verbunden mit einem Alkylrest $\ce{R}$, also einer Alkoxygruppe.
Der Sauerstoff der $\ce{C-O}$-Doppelbindung hat eine hohe Elektronendichte und damit eine negative Partialladung. Der Kohlenstoff der $\ce{C-O}$-Doppelbindung hat eine geringe Elektronendichte und damit eine positive Partialladung.
Durch die positive Partialladung ist das Kohlenstoffatom elektrophil. Nucleophile greifen daher bevorzugt das Kohlenstoffatom der Estergruppe an. Das Sauerstoffatom mit der negativen Partialladung wiederum ist nucleophil und bindet beispielsweise bevorzugt Protonen $\ce{H+}$.
Diese Eigenschaften sind besonders wichtig bei der Umkehrreaktion der Veresterung.
Die Esterverseifung – Umkehrreaktion der Veresterung
Die Veresterung rückwärts formuliert
Ester reagieren mit Wasser zurück zu Carbonsäuren und Alkohol. Da die Spaltung durch Reaktion mit Wasser geschieht, handelt es sich hierbei um eine Hydrolyse.
Die Reaktion kann als saure Hydrolyse oder alkalische Hydrolyse verlaufen. Die alkalische Hydrolyse von Estern wird auch Esterverseifung genannt.
Die saure Hydrolyse
Die saure Hydrolyse eines Esters ist die säurekatalysierte Veresterung genau rückwärts. Die saure Hydrolyse findet daher ebenfalls in fünf Schritten statt.
- Im ersten Schritt findet die Protonierung statt. Das Proton $\ce{H+}$ der Säure bindet sich an das Sauerstoffatom der Carboxygruppe des Esters 1. Dabei klappen die Elektronen der $\ce{C-O}$-Doppelbindung zum Sauerstoffatom um. Es entsteht ein positiv geladenes Kohlenstoffatom, das Carbokation 2.
- Im nächsten Schritt greift das nucleophile Sauerstoffatom des Wassermoleküls das Carbokation 2 an. Die positive Ladung verschiebt sich zum Sauerstoffatom 3.
- Das am positiv geladenen Sauerstoffatom benachbarte Wasserstoffatom wird vom Sauerstoffatom der Estergruppe angegriffen. Es findet eine Protonenwanderung statt.
- Die $\ce{C-O}$-Bindung löst sich, sodass der Alkohol abgespalten, also eliminiert, wird. Es entsteht wieder ein Carbokation 4. Die Elektronen am Sauerstoffatom verschieben sich erneut, sodass wieder eine $\ce{C-O}$-Doppelbindung entsteht. Die positive Ladung wandert vom Kohlenstoffatom 4 zum Sauerstoffatom 5.
- Das Bindungselektronenpaar zwischen dem Sauerstoffatom und dem Wasserstoffatom verschiebt sich zum Sauerstoffatom. Durch die daraus folgende Abspaltung des Protons $\ce{H+}$, also die Deprotonierung, entsteht die Carbonsäure 6.
Die alkalische Hydrolyse
Die alkalische Hydrolyse führt nicht wie die saure Hydrolyse zurück zu einer Carbonsäure, sondern einem Salz bestehend aus einem Carboxylation und einem Kation aus der anfangs eingesetzten Base.
Meist wird Natronlauge eingesetzt. Natronlauge ist eine wässrige Lösung von Natriumhydroxid. In wässriger Lösung liegt Natriumhydroxid $\ce{NaOH}$ in Form von $\ce{Na+}$-Kationen und $\ce{OH-}$-Ionen vor.
Die Reaktion eines Esters mit Natronlauge ergibt ein Natriumcarboxylat.
Die alkalische Hydrolyse verläuft in drei Schritten.
- Im ersten Schritt findet ein nucleophiler Angriff statt. Das Hydroxidion $\ce{OH-}$ greift das Kohlenstoffatom der Estergruppe an und die Elektronen der Doppelbindung verschieben sich zum Sauerstoffatom. Ein Anion wird gebildet.
- Durch eine erneute Verschiebung eines Elektronenpaars am Sauerstoff wird die $\ce{C-O}$-Doppelbindung wiederhergestellt. Dabei wird ein Alkoholation abgespalten und die Carbonsäure gebildet.
- Schließlich findet eine Protonenübertragung von der Carbonsäure zum Alkoholation statt, sodass ein Carboxylation und der Alkohol entstehen.
Welches Salz am Ende entsteht, ist abhängig von der eingesetzten Base. Im Fall von Natriumhydroxid entsteht ein Natriumcarboxylat.
Reagiert Essigsäureethylester mit Natriumhydroxid, entstehen Natriumacetat und Ethanol.
Fette reagieren mit Natriumhydroxid zu Glycerin und den Natriumsalzen ihrer entsprechenden Fettsäuren.
Salze von Fettsäuren werden auch Seife genannt. Daher wird die Umkehrreaktion mit Basen, also die alkalische Hydrolyse, auch als Verseifung bezeichnet. Natriumsalze, also die Produkte der Reaktion mit Natronlauge, sind die Hauptbestandteile von Kernseife.
Um nach der alkalischen Hydrolyse die Carbonsäure zu erhalten, muss das Carboxylat mit einer Säure reagieren.
Die saure und alkalische Hydrolyse im Vergleich
Die saure Hydrolyse wird durch Protonen $\ce{H+}$, die alkalische Hydrolyse hingegen durch Hydroxidionen $\ce{OH-}$ eingeleitet.
Bei der sauren Hydrolyse von Carbonsäureestern entstehen die entsprechenden Carbonsäuren und Alkohol.
Bei der alkalischen Hydrolyse von Carbonsäuren entstehen die entsprechenden Carboxylate, also Salze der Carbonsäure, und Alkohol.
Die saure Hydrolyse und die Esterbildung als Hin- und Rückreaktion ergeben zusammen eine Gleichgewichtsreaktion. Die jeweiligen Produkte der Reaktionen sind gleichzeitig die Edukte der entsprechenden Rückreaktion. Die Reaktionen sind umkehrbar, also reversibel.
Die alkalische Hydrolyse ist hingegen insgesamt nicht umkehrbar, sie ist also irreversibel. Die ersten zwei Schritte der alkalischen Hydrolyse, der nucleophile Angriff und die Abspaltung des Alkoholations, sind noch umkehrbar, aber der dritte und letzte Schritt, und zwar die Protonenübertragung von der Carbonsäure zum Alkoholation, ist nicht reversibel. Das Alkoholation ist eine so starke Base, dass es der Carbonsäure immer das Proton entreißt, sodass kein Proton mehr für die Ausbildung einer Carbonsäure zur Verfügung steht. Ohne die Ausbildung einer Carbonsäure ist die Rückreaktion blockiert.
| Art der Hydrolyse | Katalysator | Produkte | Reversibel? |
|---|---|---|---|
| sauer | $\ce{H+}$ | Carbonsäure und Alkohol | ja |
| alkalisch | $\ce{OH-}$ | Carboxylat und Alkohol | nein |
Zusammenfassung – Veresterung und Esterverseifung
Reagiert eine Säure mit Alkohol, entsteht unter Abspaltung von Wasser ein Ester.
Fettsäureglycerinester entstehen durch die Veresterung von Glycerin mit Fettsäuren unter Abspaltung von bis zu drei Wassermolekülen.
Sind alle drei Hydroxygruppen des Glycerins zum Ester reagiert, dann spricht man von einem Triglycerid.
Carbonsäureester reagieren mit Wasser zu Carbonsäuren und Alkohol. $\ce{\text{Carbonsäureester} + \text{Wasser} <=> \text{Carbonsäure} + \text{Alkohol}}$
Die Umkehrreaktion der Carbonsäureester in ihre Carbonsäure und ihr Alkohol durch die Reaktion mit Wasser ist eine Hydrolyse. Die Reaktion kann als saure Hydrolyse oder alkalische Hydrolyse verlaufen. Die alkalische Hydrolyse von Carbonsäureestern wird auch Esterverseifung genannt.
Die alkalische Hydrolyse führt nicht wie die saure Hydrolyse zurück zu einer Carbonsäure, sondern einem Salz aus dem entsprechenden Carboxylation und dem entsprechenden Alkohol.
Natriumsalze von Fettsäuren sind Seifen und entstehen durch alkalische Hydrolyse von Fetten mit Natronlauge.
Die saure Hydrolyse bildet mit der Esterbildung eine Gleichgewichtsreaktion und ist umkehrbar, also reversibel.
Die alkalische Hydrolyse ist nicht umkehrbar. Sie ist irreversibel, da das im letzten Schritt der Reaktion entstandene Alkoholation eine starke Base ist, die der Carbonsäure das für die Rückreaktion benötigte Proton entzieht.
Häufig gestellte Fragen zum Thema Veresterung und Esterverseifung
Versterung und Esterverseifung Übung
-
Nenne die Verbindungen, die zu einem Fettmolekül reagieren.
TippsFette sind selbst schon Ester.
Ein Ether ist eher Reaktionsprodukt oder Lösungsmittel.
Wasser ensteht bei der Fettbildung.
Zur Fettbildung wird ein Dreifachalkohol benötigt.
LösungFette sind Ester, die sich aus dem Dreifachalkohol Glycerin und Fettsäuren bilden. Fettsäuren sind lange, unverzweigte Alkansäuren. Bei der Reaktion entsteht Wasser.
Fette
Ein Fett sehr wohl ein Ester ist,
worüber eilig man vergisst:
Alkansäure einen Baustein stellt,
zu ihr ein Alkohohl sich flugs gesellt.
Die „Säure“ tut es nicht allein,
es muss ne lange Kette sein.
Den Stoff der Chemiker gut kennt,
trivial „Fettsäure“ er ihn nennt.
Der Alkohol, wie sollt es anders sein,
ist nur das dreifachfunktionale Glycerin allein.
Fettbildung gut vonstatten geht,
daneben Wasser noch entsteht.
Mit Ether kann man extrahieren,
doch hilft er nicht beim Reagieren.
Zum Schluss gesagt für sie und ihn:
Das Fett ist nie Cholesterin!André Otto
-
Unterscheide die Fettumwandlung in der Bratpfanne und auf dem Küchentisch.
TippsZersetzung durch Wasser heißt Hydrolyse.
Beim Braten ist es sehr heiß.
Ohne Kühlung greift Luftsauerstoff die Doppelbindung an.
LösungDurch die Hitze in der Bratwanne in Anwesenheit von Wasser werden die Fette in der Pfanne hydrolysiert. Es entstehen ein Dreifachalkohol und eine langkettige Alkansäure.
Ungeschützt auf dem Küchentisch helfen Mikroben die Doppelbindung einiger Fettsäuren durch Oxidation zu spalten. Dabei greift der Luftsauerstoff der Umgebung die Doppelbindung an. Die Reaktionsprodukte sind übelriechend.
-
Beschreibe den Zerfall des Anions.
TippsIm Anion sind die Reaktionsprodukte der Verseifung vorgebildet.
Das Anion enthält vorgebildet das Ethoxy-Ion und das Essigsäure-Molekül.
Für die Bildung des Ethoxy-Ions klappt die Bindung zwischen dem Ion und dem zentralen Kohlenstoff-Atom zum Sauerstoff-Atom des Ethoxy-Ions um.
Nach dem Verlust einer Bindung am zentralen Kohlenstoff-Atom entsteht dort eine positive Ladung, die mit der schon vorhandenen Ladung eine Bindung ausbildet.
LösungVom Anion spaltet sich ein Ethoxy-Ion. Dafür nimmt das Fragment vom zentralen Kohlenstoff-Atom das Elektronenpaar der gemeinsamen Bindung auf. Am zentralen Kohlenstoff-Atom entsteht eine positive Ladung. Es kommt zum Ladungsausgleich mit der negativen Ladung des Anions. Es entsteht eine neue Bindung. Im Ergebnis bildet sich ein Essigsäure-Molekül.
-
Erkläre das Besondere am Protonenübergang bei der Verseifung.
TippsAuch die schwachen Alkansäuren liefern ausreichend Protonen.
Die Neutralisation von Proton und Hydroxid-Ion läuft schnell und gut ab.
Oxonium-Ionen sind in der Tat sehr stabil.
Die Reaktion von Chlorwasserstoff mit Ammoniak zum Ammoniumchlorid ist ein typischer Protonenübergang.
LösungDer Protonenübergang von der Alkansäure (z. B. Essigsäure) zum Alkoholat-Ion (z. B. Ethanolat-Ion) ist tatsächlich erstaunlich. Verwunderlich dabei sind nicht die schwachen Alkansäuren oder die angebliche Dissoziation eines Alkohols (Das ist Unsinn!). Fantastisch ist, dass der genannte Protonenübergang die augenblicklich ablaufenden Reaktionen (Neutralisation, Bildung von Oxonium-Ionen) komplett überragt.
-
Beschreibe die Hydrolyse von Fetten.
TippsZersetzung durch Wasser heißt Hydrolyse.
Fette werden im alkalischen Milieu leichter hydrolysiert.
Fettsäuren sind langkettig und unverzweigt.
LösungFett-Moleküle werden durch Wasser in ihre Bestandteile, Glycerin und Alkansäuren, hier Fettsäuren, zerlegt. Der Prozess heißt Hydrolyse. Die Fettsäuren bilden mit dem Natriumhydroxid Natriumsalze. Man nennt diese Salze Seifen, die basische (alkalische) Hydrolyse hingegen Verseifung.
-
Stelle Gleichungen für Verseifungsreaktionen auf.
TippsAus dem entstandenen Salz, wie z.B. Natriumpropanoat, lassen sich die Base (Lithiumhydroxid, Natriumhydroxid, Kaliumhydroxid) und die Alkansäure, wie z.B. Propansäure, ablesen.
Eine Alkansäure, wie z.B. Propansäure, ist Baustein des Esters.
Der entstandene Alkohol, wie z.B.Pentanol, ist der zweite Baustein des Esters.
LösungGrundsätzlich findet bei einer Verseifung eine Reaktion zwischen einem Ester und einem Hydroxid statt. Dabei entstehen immer ein Salz und ein Alkohol. Dabei lässt sich anhand der Produkte erkennen, welche Edukte eingesetzt wurden und umgekehrt. Im ersten Beispiel lässt sich aus den Produkten Natriumpropanoat und Butanol erkennen, welche Edukte eingesetzt wurden. Das Propanoat-Anion ist das Salz der Carbonsäure Propansäure und zusammen mit Butanol (dem Alkohol) haben wir die Bestandteile des Esters Propansäurebutylester. Das Kation des entstandenen Salzes verrät dir die eingesetzte Base. Wenn ein Natriumsalz entsteht, dann muss Natriumhydroxid eingesetzt worden sein.
- Aus den Produkten findest du als geeignete Edukte: Propansäurebutylester und Natriumhydroxid.
- Aus den Produkten findest du als geeignete Edukte: Ethylacetat und Kaliumhydroxid.
- Aus den Edukten findest du als geeignete Produkte: Kaliumhexanoat und Octanol.
- Aus den Edukten findest du als geeignete Produkte: Natriumpentanoat und Nonanol.
- Aus den Produkten findest du als geeignete Edukte: Heptylpentanoat und Lithiumhydroxid.
- Aus den Produkten findest du als geeignete Edukte: Natriumbutanoat und Propanol.
9.706
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.343
Lernvideos
38.737
Übungen
33.712
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?