Dynamit
Dynamit wurde von Alfred Nobel erfunden. Es handelt sich um einen explosiven Sprengstoff, der vor allem aus Nitroglycerin besteht. In dem folgenden Text kannst du mehr darüber erfahren, wie Dynamit hergestellt wird, welche Eigenschaften es hat und warum es explodiert. Bist du neugierig? Dann lies weiter!
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Grundlagen zum Thema Dynamit
Dynamit – Chemie
Weißt du, was in Dynamit enthalten ist? Wieso explodiert es und was passiert eigentlich bei der Explosion? In diesem Lerntext gehen wir genau diesen Fragen auf den Grund.
Was ist Dynamit? – Definition
Dynamit ist ein Sprengstoff, der von dem Chemiker Alfred Nobel im Jahr 1866 entdeckt wurde. Dynamit besteht aus $75\%$ Nitroglycerin, $24,5\%$ Kieselgur und $0,5\%$ Natriumcarbonat. Der eigentliche Sprengstoff ist dabei das Nitroglycerin. Kieselgur ist eine weißliche, pulverförmige Substanz, die hauptsächlich aus den Schalen fossiler Kieselalgen besteht und dem Nitroglycerin als sogenanntes Trägermaterial beigemischt wird. Als chemischer Stabilisator wird noch ein wenig Soda (Natriumcarbonat) hinzugefügt. Du weißt nun, woraus Dynamit besteht. Im Folgenden wollen wir uns mit dem Hauptbestandteil Nitroglycerin genauer beschäftigen. Um die Herstellung, die Eigenschaften und die Explosion von Dynamit zu verstehen, schauen wir uns zuerst an, was Nitroglycerin überhaupt ist.
Was ist Nitroglycerin? – Definition
Der Hauptbestandteil von Dynamit ist der explosive Stoff Nitroglycerin $(\ce{C3H5N3O9})$. Nitroglycerin ist ein Ester, der aus dem Alkohol Glycerin und der anorganischen Salpetersäure besteht. Weitere Namen für Nitroglycerin sind in der folgenden Liste aufgeführt:
- Propan-1,2,3-triyltrinitrat (IUPAC)
- Glyceroltrinitrat
- Glycerintrinitrat
- Trisalpetersäureglycerinester
Herstellung von Nitroglycerin
Um Nitroglycerin (Trisalpetersäureester) herzustellen, wird Glycerin $(\ce{CH2OH-HCOH-H2COH})$ mit Salpetersäure $(\ce{HNO3})$ und Schwefelsäure $(\ce{H2SO4})$ zusammengemischt. Da bei der Reaktion sehr viel Wärme entsteht, muss das Gemisch ständig gekühlt werden. Als Produkte entstehen Nitroglycerin (Trisalpersäureester) und Wasser. Die Reaktionsgleichung siehst du hier:
Eigenschaften von Nitroglycerin
Nitroglycerin ist eine farblose bis gelbliche Flüssigkeit und instabil gegenüber mechanischer (Stöße) und thermischer (Wärme) Energie, was zur Explosion führt. Bekommt Nitroglycerin von außen einen solchen Stoß oder kommt es zu Wärmeeinwirkung, dann reagiert das Nitroglycerin zu den Gasen Kohlenstoffdioxid, Wasser, Stickstoffdioxid und Stickstoff.
$\ce{4mol Nitroglycerin ->[Explosion] }$ $\ce{12 mol CO2 + 10 mol H2O + 2 mol NO2 + 5 mol N2}$
Aus einer Stoffmenge von vier Mol Flüssigkeit entsteht so insgesamt 29 Mol Gas. Es handelt sich also um eine enorme Volumenzunahme in sehr kurzer Zeit, was als Explosion wahrgenommen wird. Durch das Beimischen von Kieselgur und Natriumcarbonat wird das Nitroglycerin zu Dynamit, das viel weniger empfindlich auf Stöße und Wärme reagiert als pures Nitroglycerin.
Nitroglycerin hat bei Einnahme eine gefäßerweiternde Wirkung auf den menschlichen Körper und findet daher auch in der Medizin Verwendung. Nitroglycerin zerfällt im Körper und setzt dabei Stickstoffmonoxid frei, das auf glatte Muskelzellen in den Blutgefäßen entspannend wirkt. Das entlastet das Herz. Es gibt Nitroglycerin als Spray oder Kapsel für Notfälle, aber auch als regelmäßig einzunehmendes Medikament bei gewissen Herzerkrankungen.
Wer hat das Dynamit erfunden? – der Erfinder Nobel
Und wie wurde Dynamit erfunden? Im Jahr 1857 wurde das Nitroglycerin entdeckt. Es war ein wirkungsvoller Sprengstoff, jedoch kam es aufgrund der Empfindlichkeit von Nitroglycerin zu sehr vielen schweren Unfällen. Alfred Nobel fing an, zu experimentieren, um Nitroglycerin besser händelbar zu machen. Er entwickelte im Jahr 1866 das Nitroglycerin weiter zu Dynamit, das viel weniger empfindlich auf Stöße und Wärme reagiert. Damit wurde eine kontrollierte Sprengung über eine Initialzündung möglich. Letztere erzeugt einen Detonationsdruck, der dann die Explosion auslöst. Dynamit wurde in großen Mengen verfügbar. Es wurde viel im Bergbau, in Steinbrüchen und für den Straßen- und Tunnelbau verwendet – es ereigneten sich jedoch erneut schwere Unfälle, die auf unsachgemäße Behandlung des Sprengstoffs zurückzuführen waren. Feuchtes Dynamit verlor langsam seinen Nitroglycerinanteil – das Nitroglycerin konnte sich dann aufgrund seiner Dichte unbemerkt in Senken oder Pfützen in erheblicher Menge sammeln und plötzlich explodieren.
Heutzutage benutzt man Sprengstoffe, die sicherer sind und eine größere Sprengkraft besitzen. Zu diesen werden zum Beispiel Octogen und CL20 gezählt.
Dieses Video
In diesem Video lernst du, aus was Dynamit besteht, und du erfährst, was in Dynamit drin ist. Wie empfindlich Dynamit ist, ist dabei abhängig von der Handhabung und der Umgebung des Sprengstoffs. In einer feuchten Umgebung kann der explosive Stoff Nitroglycerin austreten, der sehr empfindlich auf mechanische oder thermische Energie reagiert.
Im Anschluss an das Video und diesen Text findest du Übungsaufgaben, um dein erlerntes Wissen zu überprüfen. Viel Spaß!
Transkript Dynamit
Hallo, ich bin Mathias.
Willkommen zu Chemie.
In diesem Video geht es um Dynamit.
Vielleicht hast du ja die roten Stangen, die nach Zündung explodieren, schon einmal gesehen.
Weißt du eigentlich was da drin ist?
Und warum explodiert es?
Das wirst du jetzt in meinem Video erfahren. Es gliedert sich wie folgt.
Als erstes zeige ich dir den Sprengstoff, der im Dynamit enthalten ist.
Dann sehen wir uns dessen Herstellung an.
Anschließend werde ich auf die Eigenschaften des Sprengstoffes eingehen.
Danach erkläre ich dir was bei der Explosion passiert und wie es zur Erfindung des Dynamits kam.
Am Schluss gibt es noch eine kurze Zusammenfassung.
Warum explodieren nun also die Dynamitstangen nach dem Anzünden?
Dies liegt an dem in Dynamit enthaltenen Sprengstoff Nitroglycerin.
Wie es aufgebaut ist siehst du hier. Das Molekül ist also ein Ester, bestehend aus dem Alkohol Glycerin und der anorganischen Säure Salpetersäure.
Der Name Nitroglycerin ist daher formal gesehen falsch, als Trivialname aber sehr geläufig.
Denn als Nitrogruppe wird eine NO2-Gruppe nur bezeichnet wenn sie über ein Kohlenstoff-Atom verknüpft ist.
In einem Ester ist sie aber über eine Sauerstoffbrücke verknüpft. Durch diesen weiteren Sauerstoff wird es zu NO3, dies wird als Nitrat bezeichnet.
Der systematische Name ist Laut IUPAC also Propan-1,2,3-triyltrinitrat.
Nun weißt du wie Nitroglycerin aufgebaut ist. Aber wie wird es hergestellt?
Man benötigt Glycerin und Nitriersäure.
Glycerin, ein 3- wertiger Alkohol, wird zu Nitriersäure gegeben.
Nitriersäure ist ein Gemisch aus Salpeter- und Schwefelsäure. Dabei muss ständig gekühlt werden, da bei der Reaktion viel Wärme frei wird.
Als Produkt entsteht Nitroglycerin und Wasser. Was hat das entstandene Nitroglycerin nun für Eigenschaften?
Es ist eine farblose bis gelbliche Flüssigkeit.
Die Substanz ist instabil. Kommt es bei größeren Mengen zur Einwirkung von mechanischer Energie, sprich Stöße, oder thermischer Energie erfolgt eine Explosion.
Daher ist der Umgang mit dieser Chemikalie sehr gefährlich.
Dies ist auch der Grund für die Kühlung bei der Herstellung.
Nitroglycerin wird auch in der Medizin angewandt. In kleinen Mengen durch den Mund aufgenommen, hat es eine gefäßerweiternde Wirkung. Es wirkt somit blutdrucksenkend.
Du weißt nun wie Nitroglycerin aussieht, wie es hergestellt wird und was es für Eigenschaften hat. Jetzt sehen wir uns die Reaktion der Explosion mal im Detail an. Wenn Nitroglycerin von außen durch einen Stoß oder Wärmeeinwirkung gezündet wird, kommt es zur Explosion. Dabei werden aus 4 mol flüssigen Nitroglycerin 12 mol Kohlendioxid, 10 mol Wasser, 2 mol Stickstoffdioxid und 5 mol Stickstoff. Die Reaktionsprodukte sind alle gasförmig. Aus 4 mol einer Flüssigkeit werden also insgesamt 29 mol Gas. Diese ernorme Volumenzunahme geschieht in kürzester Zeit. Sie wird von uns als Explosion wahr genommen. Wie du siehst ist Nitroglycerin eine sehr gefährliche Substanz. Daher machte sich Alfred Nobel Gedanken wie er sie sicherer und besser handhabbar machen kann. Seine Lösung war Kieselgur als Absorptionsmaterial zu benutzen. Dieses saugt das Nitroglycerin auf und macht es so unempfindlich gegen Stöße. Weiterhin verwendete er Natriumcarbonat als Stabilisator. So wurde eine kontrollierte Sprengung möglich. Allerdings wurde damit auch eine Initialzündung notwendig. Diese erzeugt einen Detonationsdruck, der dann die eigentliche Explosion auslöst. Heutzutage hat Dynamit an Bedeutung verloren. Es wurde abgelöst von Sprengstoffen die noch sicherer sind und eine größere Sprengkraft haben, wie zum Beispiel Octogen und CL20. Du hast nun viel über Dynamit gelernt. Ich werde es zum Abschluss des Videos noch einmal zusammenfassen. Dynamit enthält Nitroglycerin. Dieses wird unter ständiger Kühlung aus Glycerin und Nitriersäure hergestellt. Durch Stöße und Wärme kann es leicht zur Explosion gebracht werden. Bei der Explosion kommt es zu einer plötzlichen großen Volumenzunahme. Alfred Nobel erfand die Absorption des Nitroglycerins durch Kieselgur. Dadurch machte er es handhabbar und sicherer.
Ich danke dir für deine Aufmerksamkeit und wünsche dir noch viel Erfolg beim Lernen. Bis zum nächsten mal, dein Mathias.
Dynamit Übung
-
Nenne Eigenschaften von Nitroglycerin.
TippsStöße oder etwas Wärme genügen, um Nitroglycerin zur Explosion zu bringen.
LösungNitroglycerin ist bekannt als Sprengstoff und Bestandteil von Dynamit. Sein Einsatz als Sprengstoff beruht auf der Instabilität des Moleküls. Der Umgang mit dieser Verbindung ist daher sehr gefährlich und auch bei der Synthese müssen Vorsichtsmaßnahmen getroffen werden. Nitroglycerin ist eine farblose bis gelbliche Flüssigkeit und wird auch in der Medizin angewendet. Das blutdrucksenkende Mittel trägt den Namen Glyceroltrinitat. Es kann Nebenwirkungen wie Kopfschmerzen oder Hitzegefühl auslösen.
-
Formuliere die Reaktion für die Explosion von Nitroglycerin.
TippsDenke daran auszugleichen, alle Elemente der Eduktseite müssen auch auf der Produktseite auftauschen.
LösungDa vier Mol Nitroglycerin reagieren und aus der Summenformel drei Kohlenstoffatome ersichtlich sind, ergeben sich zwölf Mol $CO_2$. Ähnlich verhält es sich mit Wasser. Fünf Atome Wasserstoff sind im Ausgangsmolekül enthalten. Multipliziert mit vier, ergibt sich 20. Da Wasser zwei Wasserstoffmoleküle enthält, ergibt sich die Lösung $10~H_2O$. Auf der Eduktseite finden sich 36 Sauerstoffatome. Auf der Produktseite sind durch Wasser und Kohlenstoffdioxid bereits 34 Sauerstoffatome vorhanden. Es ergeben sich $2~NO$. Im Vergleich zur Eduktseite fehlen auf der Produktseite weitere zehn Stickstoffmoleküle. Daher ist die letzte Lücke mit $5~N_2$ zu füllen.
Im Ergebnis lässt sich also erkennen, dass aus vier Mol des Ausgangsstoffes schlagartig 29 Mol verschiedener Gase entstehen. Diese plötzliche und enorme Volumenzunahme nehmen wir als Explosion wahr.
-
Formuliere die Reaktionsgleichung zur Synthese von Nitriersäure.
TippsBei der Protonierung wird ein Proton (um-) angelagert.
LösungNitriersäure ist eine sehr starke Säure, bestehend aus Schwefelsäure und Salpetersäure. Sie ist das Reagenz, um organische Verbindungen zu nitrieren. Ihre hohe Reaktivität beruht auf dem Nitroniumkation.
Bei der Reaktion von Schwefelsäure mit Salpetersäure wird ein Proton der Schwefelsäure an Salpetersäure angelagert. Somit entstehen ein Anion und ein Kation. Das Kation zerfällt anschließend zu Wasser und dem reaktiven Nitroniumion ${NO_2}^+$.
Je stärker eine organische Verbindung nitriert ist, desto höher ist die Explosivität.
-
Ermittle die Gefahren von Nitroglycerin.
TippsErinnere dich an die Eigenschaften von Nitroglycerin.
LösungNitroglycerin ist ein gefährlicher Stoff, der für Mensch und Umwelt gefährlich werden kann. Er ist sehr instabil und außerdem giftig. Um die Gefahren eines Stoffes richtig einschätzen zu können, auch ohne ihn zu kennen, muss er mit bestimmten Symbolen und Hinweisen beschriftet sein. Um Chemikalien zu kennzeichnen, werden Gefahrensymbole mit Sicherheitssätzen kombiniert. Letztere beschreiben Gefährdungen (H-Sätze) und Sicherheitshinweise (P-Sätze).
- H-Sätze werden unterteilt in physikalische Gefahren, Umwelt- und Gesundheitsgefahren.
- Die Unterteilung der P-Sätze erfolgt in Allgemeines, Prävention, Reaktion, Aufbewahrung und Entsorgung.
-
Stelle Unterschiede von Glycerin und Nitroglycerin heraus.
TippsAus Alkohol und Säure wird ein Ester.
LösungGlycerin ist der Ausgangsstoff für Nitroglycerin. Es ist ein dreiwertiger Alkohol mit dem systematischen Namen Propan-1-2-3-triol, es enthält also drei Hydroxygruppen $(-OH)$. Damit ist es gut in Wasser zu lösen, da es stark polar ist.
Wird Glycerin nun mit Salpetersäure verestert, entsteht Nitroglycerin, welches den systematischen Namen Propan-1-2-3-triyl-trinitrat hat. Diese Verbindung ist sehr instabil und detoniert leicht. Durch die Veresterung der Hydroxygruppen wird das Molekül schlechter in Wasser löslich.
-
Ermittle die Edukte, die für folgende Ester nötig sind.
TippsButtersäure ist auch bekannt als Butansäure.
Zähle die Kohlenstoffatome ab der Esterbindung.
Der Trivialname Essigsäure wird der Ethansäure zugeordnet.
LösungBei der Veresterung reagieren ein Alkohol und eine Säure unter Wasserabspaltung zu einem Ester. Reagiert ein primärer oder tertiärer Alkohol mit einer Carbonsäure, dann wird ein Proton vom Alkohol und eine Hydroxygruppe von der Carbonsäure abgespalten. Sie bilden das Nebenprodukt $H_2O$. Welche Carbonsäure zur Entstehung des Esters eingesetzt wurde, kannst du an der Anzahl der Kohlenstoffatome erkennen. Bei zwei Kohlenstoffatomen handelt es sich um Essigsäure (Ethansäure), bei vier Kohlenstoffatomen um Buttersäure (Butansäure) und bei 16 um Hexadecansäure.
- Die erste Verbindung trägt den Namen Triacetin. Es ist eine farblose, ranzig riechende Flüssigkeit, die zum Teil in Wasser löslich ist. Zur Anwendung kommt dieser Stoff als Weichmacher für Lacke und Klebstoffe oder als Aromaträger in der Lebensmittelindustrie.
- Als Zweites war Tripalmitin dargestellt. Dieser Ester kommt natürlich nicht vor und wird hergestellt für Studien. Palmitinsäure $C_{16}H_{32}O_2$ hingegen kommt natürlich in tierischen und pflanzlichen Fetten vor. Die Salze (Palmitate) werden oft in Kosmetika angewendet.
- Die dritte Verbindung (Tributtersäureglycerinester) ist ölig und farblos. Das Fett ist wichtig für unsere Ernährung. Es kommt als Weichmacher oder Futtermittelzusatzstoff zur Anwendung.
9.892
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.306
Lernvideos
38.669
Übungen
33.706
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
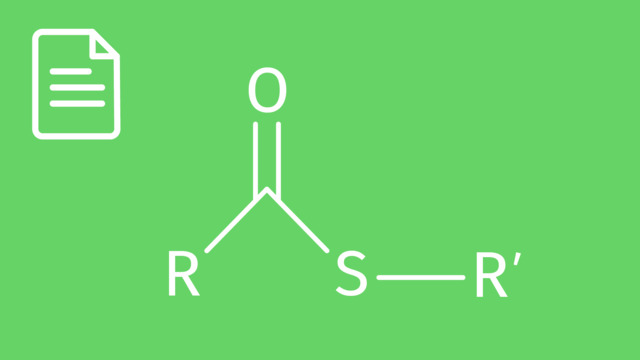
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?