Glucose – Kette oder Ring?


in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
Glucose – Kette oder Ring? Übung
-
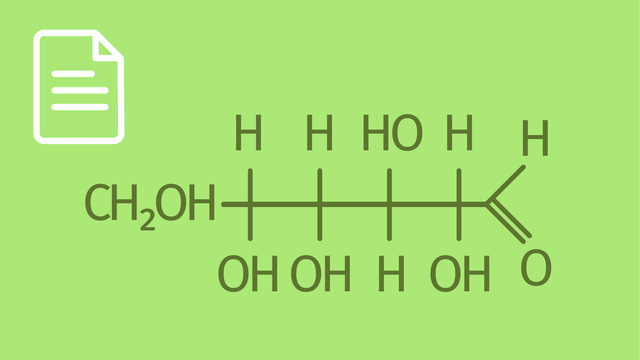
Benenne die Funktionalitäten der D-Glucose.
TippsEine sekundäre Hydroxygruppe sitzt an einem C-Atom, welches nur noch ein H-Atom und zwei weitere Alkylreste trägt.
LösungObiges Bild zeigt die Mutarotation der Glucose im wässrigen Medium. Die Mutarotation bezeichnet, dass in wässriger Form die $\alpha$- und $\beta$-D-Glucose im Gleichgewicht vorliegen. Dieses Gleichgewicht kann über ein Polarimeter bestimmt werden, da beide chiralen Substanzen das linear polarisierte Licht um verschiedene Winkel drehen.
Ursache für die Mutarotation ist, dass die cyclische und die offenkettige Form im Gleichgewicht stehen. Da die Aldehyd-Funktionalität wegen des $sp^2$-Charakters planar ist, kann die Hydroxygruppe entweder oberhalb der entstehenden Ringebene oder unterhalb davon angreifen. Diese Unterschiede führen zur $\alpha$- und der $\beta$-Form, wobei in der $\alpha$-Form die glycosidische Hydroxygruppe unterhalb der Ringebene liegt.
Die glycosidische Hydroxygruppe ist keine „normale“ sekundäre Hydroxygruppe, sondern sie gehört zur Struktureinheit des Halbacetals. Diese Gruppe ermöglicht mit Alkoholen jeglicher Art, ein Vollacetal zu bilden. Dies ist vergleichbar mit der Reaktion von einem Aldehyd mit einem Diol.
Darüber hinaus verfügt der Zucker sowohl in der Kette als auch im Ring über eine primäre Hydroxygruppe, die an einer $-CH_2$-Gruppe sitzt, und mehrere sekundäre Hydroxygruppen, die an den vierfach verzweigten Kohlenstoffatomen sitzen. Diese sind Chiralitätszentren (vier verschiedene Substituenten an einem Kohlenstoffatom).
-
Erkläre die Acetalisierung der Glucose.
TippsViele natürliche Substanzen liegen in Sechsringen vor, da in diesen eine sehr kleine Ringspannung herrscht.
LösungDie Acetalisierung von Zuckern ist eine intramolekulare Reaktion, d.h. sie erfolgt zwischen den Gruppen eines Moleküls. Eine Acetalisierung ist die Reaktion zwischen einem Aldehyd und einem Alkohol. Beim Zucker ist eine Besonderheit, dass die Acetalisierung bei dem Halbacetal stoppt, deswegen ist die aus der Carbonylgruppe gebildete Hydroxygruppe sehr reaktiv und geht andere Reaktionen ein als die restlichen Hydroxygruppen. So reagiert sie z.B. sofort bei Zugabe eines Alkohols zum Vollacetal. Diese Hydroxygruppe wird auch glycosidische Hydroxygruppe genannt. Bei der Acetalisierung laufen folgende Schritte ab:
- Protonierung der Carbonylfunktion (orange) durch die Hydroxygruppe am C5-Kohlenstoffatom.
- Umlagerung des Kations zur Bildung eines Carbokations.
- Angriff des Sauerstoffatoms vom C5-Kohlenstoffatom auf das Carbokation (C1-Position) und Bildung eines Halbacetals (grün).
-
Beschreibe das Gleichgewicht zwischen den zwei anomeren Formen der Zucker.
TippsNur bestimmte Zentren aus einem Molekül sorgen dafür, dass linear polarisiertes Licht gedreht wird. Wie heißen diese und worin unterscheiden sich die $\alpha$- und $\beta$-Form der Zucker?
Chirale Zentren, die vier verschiedene Substituenten tragen, sorgen für optische Aktivität.
LösungAls Anomere werden in der Zuckerchemie besondere Isomere bezeichnet. Anomere sind Stoffe, die sich in ihrer Konfiguration nur am anomeren Kohlenstoffatom unterscheiden. Dieses umfasst damit die $\alpha$- und $\beta$-Formen der Zucker.
Obiges Bild zeigt die Mutarotation der Glucose im wässrigen Medium. Die Mutarotation bezeichnet, dass in wässriger Form die $\alpha$- und $\beta$-D-Glucose im Gleichgewicht vorliegen. Dieses Gleichgewicht kann über ein Polarimeter bestimmt werden, da beide chiralen Substanzen das linear polarisierte Licht um verschiedene Winkel drehen.
Ursache für die Mutarotation ist, dass die cyclische und die offenkettige Form im Gleichgewicht stehen Da die Aldehyd-Funktionalität wegen des $sp^2$-Charakters planar ist, kann die Hydroxygruppe entweder oberhalb der entstehenden Ringebene oder unterhalb davon angreifen. Diese Unterschiede führen zu der $\alpha$- und der $\beta$-Form, wobei in der $\alpha$-Form die glycosidische Hydroxygruppe unterhalb der Ringebene liegt.
-
Bestimme die Fischer- und Haworth-Formeln folgender Zucker.
TippsFLOH: Fischer Links Oben Haworth
LösungDie beiden Zucker sind D-Galactose und D-Allose. Um ihre Fischer-Projektion in die Haworth-Schreibweise zu überführen, dient die FLOH-Regel (Fischer Links Oben Haworth). Nach dieser Regel stehen in der Haworth-Projektion die Wasserstoffatome und Hydroxygruppe oberhalb der Ringebene, die in der Fischer-Projektion links stehen und umgekehrt.
-
Identifiziere die $\beta$-Form der Glucose.
TippsDie $\beta$-Glucose entsteht, wenn die Hydroxygruppe bei der Acetalisierung von oben angreift.
Die $\beta$-Form der Glucose überwiegt in wässriger Lösung.
LösungAls Anomere werden in der Zuckerchemie besondere Isomere bezeichnet. Anomere sind Stoffe, die sich in ihrer Konfiguration nur am anomeren Kohlenstoffatom unterscheiden. Dieses umfasst damit die $\alpha$- und $\beta$-Formen der Zucker.
Ursache für die Bildung der beiden Anomere ist das planare, $sp^2$-hybridiserte Carbon-Kohlenstoffatom. Dadurch, dass es planar ist und nur drei verschiedene Substituenten trägt, ist es nicht chiral. Ein Angiff der Hydroxygruppe kann unterhalb oder oberhalb der Ebene erfolgen, die durch die $-C=O$-Bindung aufgespannt wird. Je nach der Angriffsseite entstehen zwei stereochemisch differenzierte Konfigurationen. Solche Zentren werden auch prochirale Zentren genannt.
Die $\beta$-Form entsteht, wenn die Hydroxygruppe vom fünften C-Atom von oben auf die Aldehydgruppe angreift. Die entstandene Hydroxygruppe befindet sich dann oberhalb der Ringebene. In wässriger Lösung wird diese Form aufgrund von günstigen Wechselwirkungen mit dem polaren Wassermolekül begünstigt.
-
Beweise, dass auch die Kettenform des Zuckers im Gleichgewicht vorliegt.
TippsDie dritte Reaktion wird auch Silberspiegelprobe genannt.
LösungDer hauptsächliche Unterschied von der Kettenform zur Ringform ist, dass bei der Kettenform eine Aldehyd-Gruppe als reaktive, funktionelle Gruppe vorliegt. In der Kettenform liegt diese als Halbacetal umgeformt vor.
Reaktionen, die zum Nachweis des Aldehyd-Charakters von Zuckern dienen, sind die Silberspiegelprobe und die Fehling-Probe.
- Die Silberspiegelprobe erfolgt mit dem Tollens-Reagenz (ammoniakalische Silbernitratlösung), wobei durch den Aldehyd die Silber(I)-Ionen zu metallischem Silber reduziert werden, welches sich als Spiegel an der Reagenzglaswand abscheidet.
- Die Fehling-Probe erfolgt mit der Fehling-I-Lösung (Kupfer(II)-sulfat) und der Fehling-II-Lösung (Kaliumnatriumtartrat) im Basischen. Bei dieser Reaktion werden durch die Aldehyd-Gruppe die Kupfer(II)-Ionen zu Kupfer(I)-Ionen reduziert, die als ziegelrotes Kupfer(I)-oxid einen Niederschlag bilden.
9.714
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.341
Lernvideos
38.742
Übungen
33.718
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen









