Kohlenhydrate
Glucose, Fructose, Monosaccharide - 3 bis 6 C-Atome, Nomenklatur, Stereochemie, Stärke, Cellulose, Stärke, Glykogen, Moleküldarstellung
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Definition - Was sind Kohlenhydrate?
Kohlenhydrate sind lebenswichtig für alle Lebewesen. Die Bezeichnung Kohlenhydrat gibt schon einen ersten Anhaltspunkt über die Bestandteile der Moleküle, nämlich dass sie aus Kohlenstoff und Wasser bestehen. Natürlich ist das eine recht ungenaue Beschreibung des Aufbaus. Chemisch sind Kohlenhydrate Polyhydroxyaldehyde oder Polyhydroxyketone. Die Moleküle besitzen also mehrere Hydroxygruppen und eine Aldehyd- bzw. Ketogruppe.
Monosaccharide
Die kleinsten Kohlenhydrate sind die Monosaccharide oder auch Einfachzucker. In der Regel besitzen sie 3 bis 6 Kohlenstoffatome.
- 3 C-Atome: Triose
- 4 C-Atome: Tetrose
- 5 C-Atome: Pentose
- 6 C-Atome: Hexose
Besitzen die Zucker eine Ketogruppe, also eine mittelständige Carbonylfunktion, werden sie Ketosen genannt. Besitzen sie eine Aldehydgruppe, also eine endständige Carbonylfunktion, werden sie Aldosen genannt.
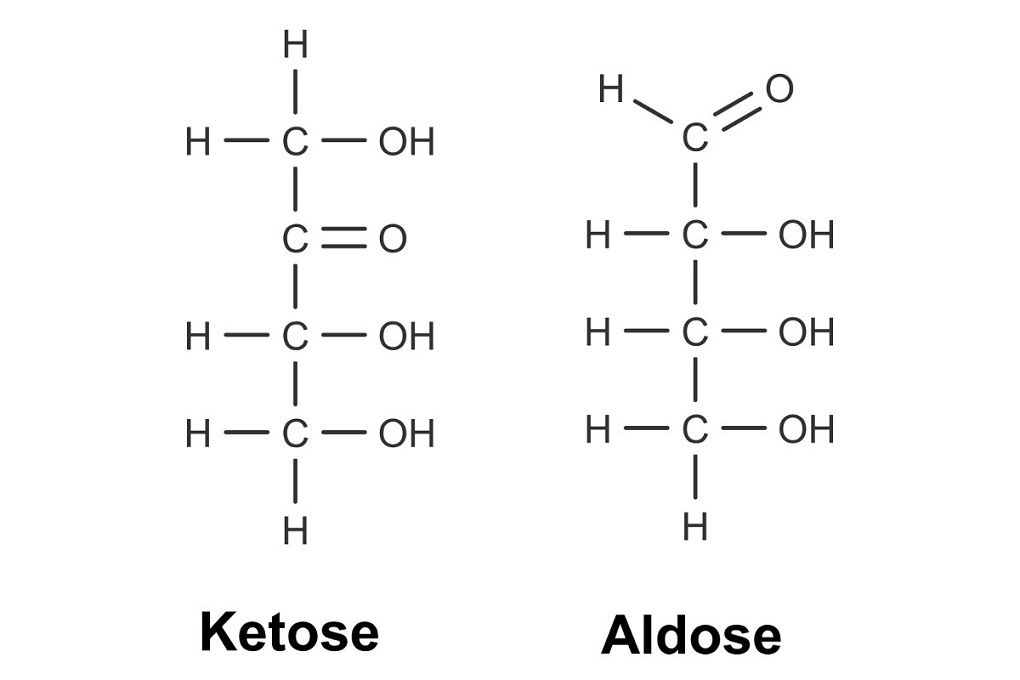
Glucose (Traubenzucker) und Fructose (Fruchtzucker) gehören zu den bekanntesten Monosacchariden. Beide Zucker sind Hexosen, da sie 6 Kohlenstoffatome im Molekül haben. Die Glucose ist allerdings eine Aldose und die Fructose ist eine Ketose.

Um die Konfiguration von Kohlenhydraten zu beschreiben, gibt es die D/L-Notation. Dabei wird das am weitesten untenstehende chirale Kohlenstoffatom in der Fischer-Projektion betrachtet. Steht die OH-Gruppe auf der rechten Seite, handelt es sich um einen D-Zucker, steht sie auf der linken Seite, handelt es sich um einen L-Zucker.

Ringbildung
Neben der offenkettigen Form, existieren Monosaccharide auch in der Ringform. An der Kettenform befinden sich eine Aldehydfunktion und mehrere OH-Gruppen. Aldehyde und Alkohole reagieren miteinander zu einem Halbacetal. Erfolgt diese Halbacetalbildung nun beim Zuckermolekül intramolekular, erfolgt ein Ringschluss.

Die entstehenden Ringe sind entweder fünfgliedrig, dann werden sie Furanosen genannt, oder sie sind sechsgliedrig, dann werden sie Pyranosen genannt. Bei diesem Ringschluss entstehen zwei anomere Formen des Zuckers. Bei der β-Form zeigt die OH-Gruppe am anomeren Kohlenstoffatom nach oben und bei der α-Form zeigt die OH-Gruppe nach unten.

Da Aldosen durch ihre Aldehydgruppe ähnliches Reaktionsverhalten zeigen wie die Aldehyde, können sie auch durch die typischen Aldehydnachweise wie Fehling-Probe oder Tollensprobe nachgewiesen werden.
Vom Einfachzucker zum Vielfachzucker
Monosaccharide können mit weiteren Monosacchariden reagieren. Dabei entsteht eine glycosidische Bindung zwischen dem anomeren Kohlenstoffatom eines Monosaccharids und der Hydroxygruppe eines anderen Monosaccharids. Die Verknüpfung kann α-glycosidisch oder β-glycosidisch erfolgen.
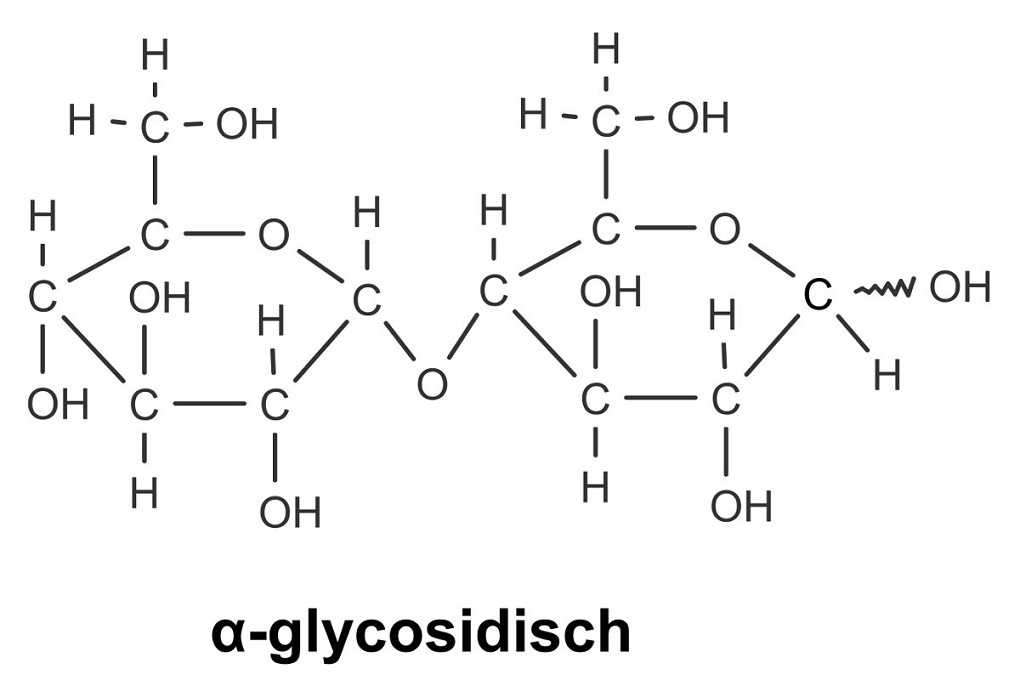
Kohlenhydrate bestehend aus zwei Bausteinen werden als Disaccharide bezeichnet. Zu den wichtigsten Disacchariden gehören:
- Maltose (Malzzucker), besteht aus zwei Glucosebausteinen,
- Lactose (Milchzucker), besteht aus Glucose und Galactose, und
- Saccharose (Haushaltszucker), besteht aus Glucose und Fructose.
Bei Kohlenhydraten, die aus über mehr als 10 Bausteinen bestehen, spricht man von Polysacchariden (Vielfachzucker).
Stärke ist z.B. ein Gemisch aus den zwei Polysacchariden Amolyse und Amylopektin. Beide Polysaccharide bestehen aus Glucosebausteinen. Auch die Cellulose ist ein Polysaccharid, welches ausschließlich aus Glucosebausteinen besteht. Allerdings sind in der Stärke alle Bausteine α-glycosidisch verknüpft und in der Cellulose β-glycosidisch. Dieser kleine Unterschied sorgt dafür, dass Stärke vom Menschen enzymatisch abgebaut werden kann und Cellulose nicht.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Kohlenhydrate (22 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Kohlenhydrate (24 Arbeitsblätter)
-
 Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette
PDF anzeigen
Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette
PDF anzeigen -
 Monosaccharide
PDF anzeigen
Monosaccharide
PDF anzeigen -
 Glucose und Fructose
PDF anzeigen
Glucose und Fructose
PDF anzeigen -
 Glucose – Kette oder Ring?
PDF anzeigen
Glucose – Kette oder Ring?
PDF anzeigen -
 Monosaccharide mit 3 bis 6 C-Atomen
PDF anzeigen
Monosaccharide mit 3 bis 6 C-Atomen
PDF anzeigen -
 Monosaccharide – Nomenklatur und Stereochemie
PDF anzeigen
Monosaccharide – Nomenklatur und Stereochemie
PDF anzeigen -
 Monosaccharide – Eigenschaften und Reaktionen
PDF anzeigen
Monosaccharide – Eigenschaften und Reaktionen
PDF anzeigen -
 Pyranosen und Furanosen
PDF anzeigen
Pyranosen und Furanosen
PDF anzeigen -
 D-Ribopyranose und D-Ribofuranose
PDF anzeigen
D-Ribopyranose und D-Ribofuranose
PDF anzeigen -
 Sesselform-Schreibweise der Pyranosen
PDF anzeigen
Sesselform-Schreibweise der Pyranosen
PDF anzeigen -
 Halbacetal- und Acetalbildung
PDF anzeigen
Halbacetal- und Acetalbildung
PDF anzeigen -
 Disaccharide
PDF anzeigen
Disaccharide
PDF anzeigen -
 Disaccharide – Besondere Glykoside
PDF anzeigen
Disaccharide – Besondere Glykoside
PDF anzeigen -
 Reduzierende und nichtreduzierende Disaccharide
PDF anzeigen
Reduzierende und nichtreduzierende Disaccharide
PDF anzeigen -
 Saccharose und Maltose
PDF anzeigen
Saccharose und Maltose
PDF anzeigen -
 Polysaccharide
PDF anzeigen
Polysaccharide
PDF anzeigen -
 Polysaccharide – Cellulose, Stärke, Glykogen
PDF anzeigen
Polysaccharide – Cellulose, Stärke, Glykogen
PDF anzeigen -
 Stärke und Cellulose
PDF anzeigen
Stärke und Cellulose
PDF anzeigen -
 Nachweis von Kohlenhydraten
PDF anzeigen
Nachweis von Kohlenhydraten
PDF anzeigen -
 Moleküldarstellungen von Kohlenhydraten
PDF anzeigen
Moleküldarstellungen von Kohlenhydraten
PDF anzeigen -
 Zuckerderivate
PDF anzeigen
Zuckerderivate
PDF anzeigen -
 Glykoside und glykosidische Bindung
PDF anzeigen
Glykoside und glykosidische Bindung
PDF anzeigen -
 Glykolipide und Glykoproteine
PDF anzeigen
Glykolipide und Glykoproteine
PDF anzeigen -
 Hyaluronsäure, Heparin, Chitin
PDF anzeigen
Hyaluronsäure, Heparin, Chitin
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung



































