Nachweisreaktionen
Nachweise der Salzsäuregruppe, Reduktionsgruppe
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Analytische Chemie
- Nachweis von Wasserstoff und Sauerstoff
- Nachweis von Kohlenstoffdioxid
- Nachweis von Halogeniden
- Nachweis von Metallionen
Analytische Chemie
Die Analytische Chemie befasst sich mit der Analyse von Verbindungen. Dabei kann diese Analyse qualitativ oder quantitativ geschehen. Die quantitative Analyse untersucht einzelne Stoffe eines Stoffgemisches mengenmäßig. Dazu dienen Methoden wie Titration und die Gravimetrie.
Nachweisreaktionen sind Methoden der qualitativen Analytik. Dabei wird untersucht, aus welchen Bestandteilen Stoffe und Stoffgemische geschehen. Die mengenmäßige Zusammensetzung wird dabei nicht betrachtet. Gut untersuchbar sind Stoffe, die aus Ionen aufgebaut sind. So können Anionen wie Sulfat, Phosphat und Nitrat-Ionen mithilfe von Nachweisreaktionen bestimmt werden. Auch Acetat- und Carbonat-Ionen sind gut nachweisbar. Einige andere wichtige Nachweise werden nun eingehender beleuchtet.
Nachweis von Wasserstoff und Sauerstoff
Wasserstoff und Sauerstoff sind Gase. Sie entstehen oft als Nebenprodukte bei chemischen Reaktionen. Gasentwicklung kannst du gut an der Bläschenbildung (in wässrigem Medium) und am Schäumen erkennen. Die Kenntnis darüber, welches Gas im Reaktionsverlauf entsteht, kann dir wichtige Hinweise über die weiteren Reaktionsprodukte liefern. Um das Gas aufzufangen, benötigst du ein größeres Gefäß mit Wasser, in das du kopfüber ein mit Wasser gefülltes Reagenzglas hältst. Über ein Rohr wird das Gas aus dem Reaktionsgefäß in das Reagenzglas geleitet. Dort verdrängt es das Wasser und das Gas ist im Reagenzglas eingeschlossen. Nun kann es untersucht werden.
Eine Probe auf Sauerstoff ist die sogenannte Glimmspanprobe. Dabei entzündet man einen Holzspan und pustet ihn wieder aus, so dass er noch glimmt. Dieser wird dann in das Reagenzglas getaucht. Ist das Gas Sauerstoff, so entzündet sich der Span erneut, da Sauerstoff brandfördernd ist.
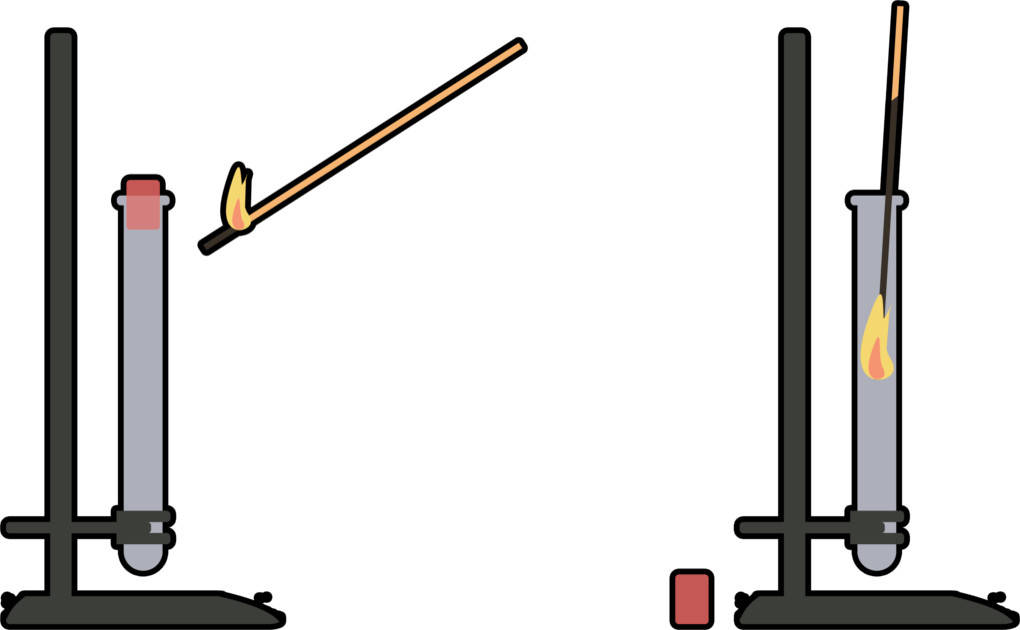
Wasserstoff wird mit der Knallgasprobe nachgewiesen. Dazu wird das Reagenzglas schräg mit der offenen Seite an eine Brennerflamme gehalten. Ist Wasserstoff vorhanden, kommt es zu einer Verpuffungsreaktion. Wasserstoff verbrennt sehr schnell. Dabei entsteht ein charakteristischer Pfeifton.
Nachweis von Kohlenstoffdioxid
Kohlenstoffdioxid ist ein nicht brennbares, farbloses Gas mit der Summenformel $\ce{CO2}$. Es ist ein natürlicher Bestandteil der Luft und ein Treibhausgas. In hohen Konzentrationen kann das Gas einen scharfen bis sauren Geruch entwickeln und erstickend wirken, ist aber normalerweise geruchlos und in niedrigen Konzentrationen ungefährlich. Zu den chemischen Eigenschaften gehören eine relativ gute Wasserlöslichkeit, wobei sich Kohlensäure $\left( \ce{H2CO3} \right)$ bildet.
Wenn Kohlenstoffdioxid mit Metallhydroxiden oder -oxiden reagiert, entstehen Hydrogencarbonate bzw. Carbonate. Der Nachweis von Kohlenstoffdioxid erfolgt mithilfe von Kalkwasser. Man nennt diese Nachweisreaktion Kalkwasserprobe.
Kohlenstoffdioxid ist nicht nur ein Produkt bei der Zellatmung, sondern Kohlenstoffdioxid entsteht auch bei der Verbrennung von organischen Stoffen.
Neben der Anwendung als Sprudelgas in Mineralwasser, Softgetränken, etc., wird es auch zum Kühlen von Lebensmitteln in Form von Trockeneis verwendet. Trockeneis ist festes Kohlenstoffdioxid und wird durch Verflüssigung von gasförmigem Kohlenstoffdioxid unter Druck und anschließendem Gefrieren hergestellt.
In der chemischen Industrie wird Kohlenstoffdioxid auch als Ausgangsstoff für Synthesen verwendet, dabei vor allem für die Herstellung von Harnstoff. Außerdem werden, aufgrund der sauerstoffverdrängenden Wirkung von Kohlenstoffdioxid, vermehrt Kohlenstoffdioxid-Feuerlöscher eingesetzt.
Nachweis von Halogeniden
Wie kann man Salze, wie Chlorid, Bromid und Iodid nachweisen? Unter den Salzen findet man viele Halogenide. Das sind Salze, die ein Halogenid-Ion wie Chlorid, Bromid und Iodid als Anion beinhalten. Diese Ionen können mithilfe von ammoniakalischer Silbernitrat-Lösung nachgewiesen werden. Dazu gibt man zur Lösung eines Halogenid-haltigen Salzes wenige Tropfen Silbernitrat. Es entsteht ein schwerlösliches Salz, ein Silberhalogenid.
- Chlorid-Ionen bilden mit Silber-Ionen das schwerlösliche Silberchlorid. Die fällt als flockiger weißer Niederschlag aus. Der Niederschlag löst sich durch Zugabe einer Lösung eines Ammoniumsalzes wieder auf.
- Bromid-Ionen fallen als Silberbromid aus. Dieser Niederschlag zeigt eine schmutzig weiße bis leicht gelbe Farbe. Er löst sich erst bei Zugabe von konzentriertem Ammoniak auf.
- Silberiodid ist ein gelber Niederschlag. Es ist noch schwerer löslich als Silberbromid. Durch Ammoniak kann es nicht wieder gelöst werden. Erst bei Zugabe von Cyanid-Ionen verschwindet der Niederschlag.
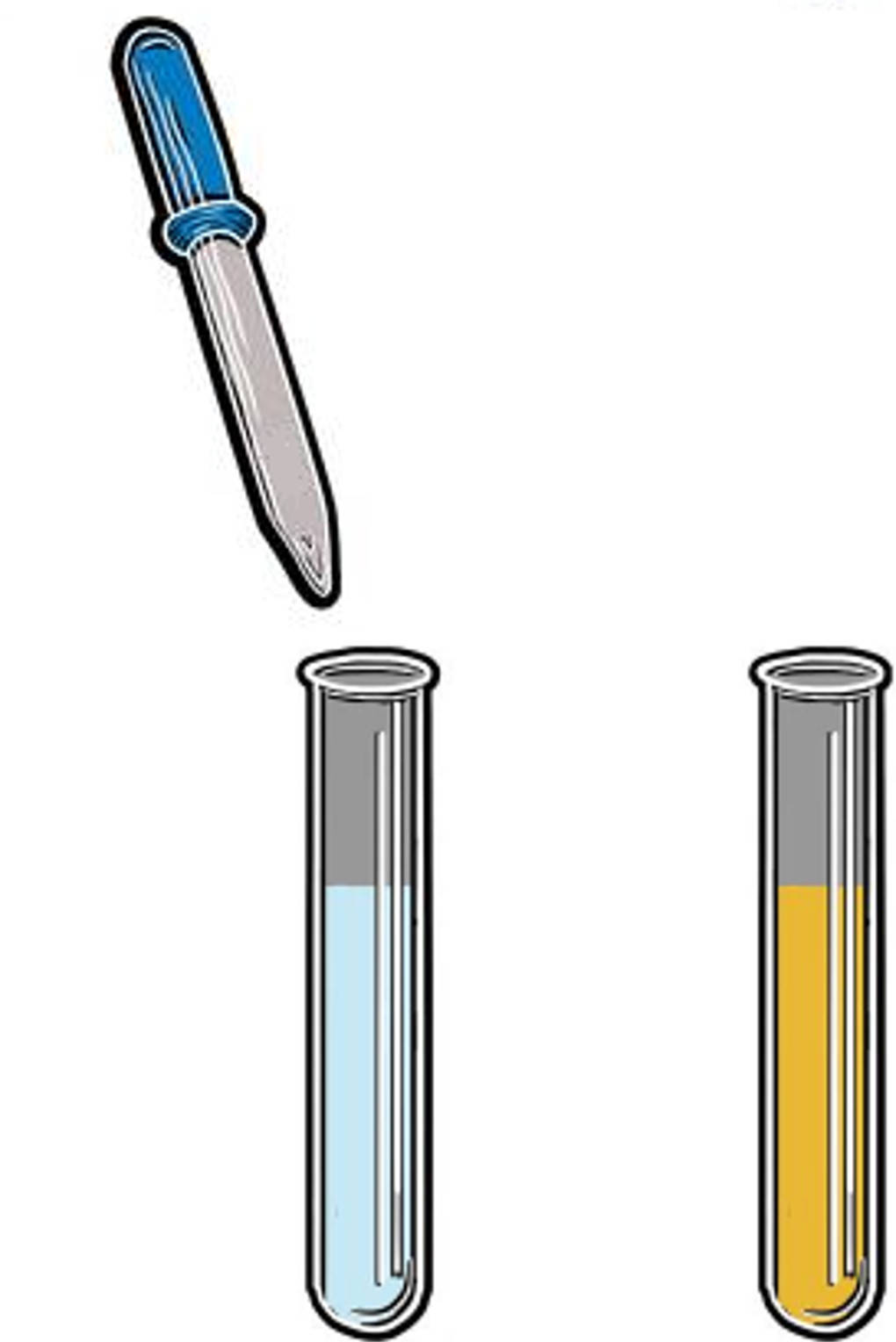
Mithilfe des Auflösens der Niederschläge können die Silberhalogenide unterschieden werden.
Nachweis von Metallionen
Metallionen kann man mithilfe der Flammenprobe nachweisen. Dazu wird ein gereinigtes Magnesiastäbchen in die zu untersuchende Probe getaucht. Anschließend hältst du das Stäbchen in die rauschende Flamme des Bunsenbrenners. Viele Metallionen zeigen eine charakteristische Flammenfärbung.
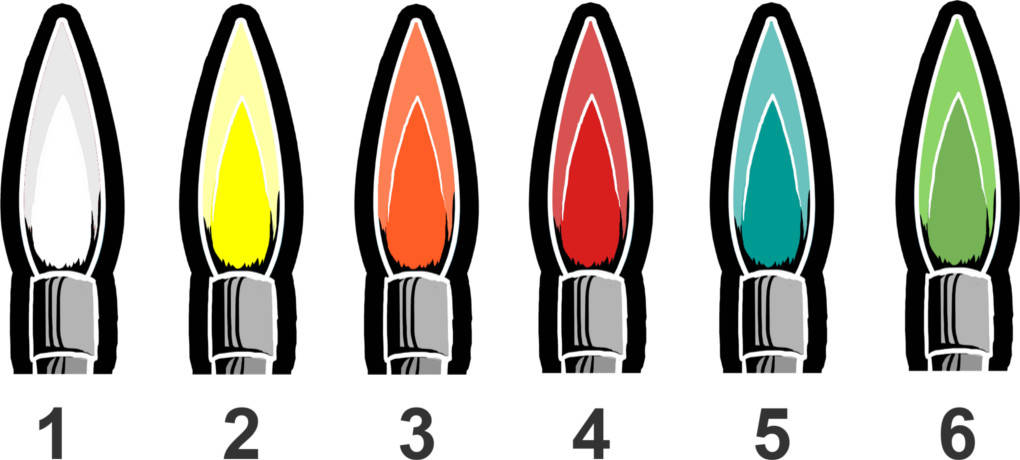
Diese kann als Lehrerexperiment durch die Verwendung von Perchlorsäure noch verstärkt werden.
- Antimon ruft eine blassblaue (1),
- Natrium eine leuchtend gelbe (2),
- Calcium eine ziegelrote (3),
- Strontium und Lithium eine kaminrote (4),
- Kupfer eine blaue bis grüne (5) und
- Barium eine grüne (6) Flamme hervor.
Da die Salze bei großer Hitze solch schöne Farben zeigen, werden sie unter anderem in Feuerwerkskörpern eingesetzt.
Leider dominiert die gelbe Flamme von Natrium die komplette Farbgebung, dadurch wird der Nachweis über Flammenfärbung von Metallionen, die neben Natrium vorliegen, deutlich erschwert.
Ein weiterer Nachweis von Metallionen ist die Herstellung von Boraxperlen, diese sind zwar weniger eindrucksvoll als die Flammenfärbungen, färben sich aber permanent ein und sind nicht durch die Gelbfärbung von Natrium dominiert. Gerade für die Ionen der Nebengruppenmetalle bietet sich dieser Nachweis an.
Alle Videos zum Thema
Videos zum Thema
Nachweisreaktionen (16 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Nachweisreaktionen (15 Arbeitsblätter)
-
 Nachweise von Wasserstoff und Sauerstoff
PDF anzeigen
Nachweise von Wasserstoff und Sauerstoff
PDF anzeigen -
 Nachweis von Kohlenstoffdioxid
PDF anzeigen
Nachweis von Kohlenstoffdioxid
PDF anzeigen -
 Nachweise von Acetat- und Carbonat-Ionen
PDF anzeigen
Nachweise von Acetat- und Carbonat-Ionen
PDF anzeigen -
 Nachweise von Sulfat-, Phosphat- und Nitrat-Ionen
PDF anzeigen
Nachweise von Sulfat-, Phosphat- und Nitrat-Ionen
PDF anzeigen -
 Nachweise von Hydroxid- und Hydronium-Ionen
PDF anzeigen
Nachweise von Hydroxid- und Hydronium-Ionen
PDF anzeigen -
 Metallionen und ihre Flammenfärbung
PDF anzeigen
Metallionen und ihre Flammenfärbung
PDF anzeigen -
 Flammenfärbung und Boraxperle
PDF anzeigen
Flammenfärbung und Boraxperle
PDF anzeigen -
 Nachweis von Chlorid, Bromid und Iodid
PDF anzeigen
Nachweis von Chlorid, Bromid und Iodid
PDF anzeigen -
 Nachweise der Salzsäure-Gruppe
PDF anzeigen
Nachweise der Salzsäure-Gruppe
PDF anzeigen -
 Nachweise der Schwefelwasserstoff-Gruppe (1)
PDF anzeigen
Nachweise der Schwefelwasserstoff-Gruppe (1)
PDF anzeigen -
 Nachweise der Schwefelwasserstoff-Gruppe (2)
PDF anzeigen
Nachweise der Schwefelwasserstoff-Gruppe (2)
PDF anzeigen -
 Nachweise der Ammoniumsulfid-Gruppe
PDF anzeigen
Nachweise der Ammoniumsulfid-Gruppe
PDF anzeigen -
 Nachweise der Ammoniumcarbonat-Gruppe
PDF anzeigen
Nachweise der Ammoniumcarbonat-Gruppe
PDF anzeigen -
 Nachweise der löslichen Gruppe
PDF anzeigen
Nachweise der löslichen Gruppe
PDF anzeigen -
 Nachweise der Reduktionsgruppe
PDF anzeigen
Nachweise der Reduktionsgruppe
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung


























