Benzol, Phenol und andere Aromaten
Benzol und Phenol sind stark giftig und wichtige Bausteine der organischen Chemie.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Benzol
Benzol ist ein Molekül der organischen Chemie und der klassische Vertreter der Aromaten. Es besteht aus sechs Kohlenstoffatomen und sechs Wasserstoffatomen. Die Summenformel des Benzols lautet $C_6H_6$. Alle Kohlenstoffatome sind $sp^2$-hybridisiert. Dadurch liegen innerhalb des Moleküls abwechselnd Einfachbindungen und Doppelbindungen zwischen den C-Atomen vor. Es gibt somit drei Doppelbindungen.
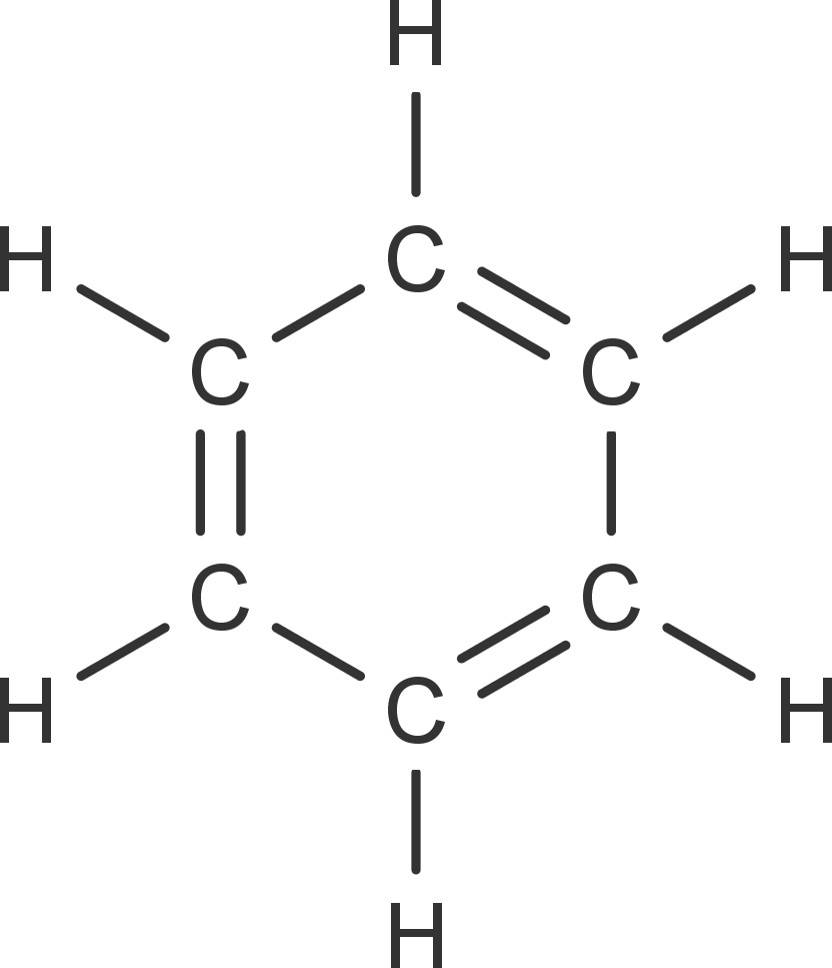
Die $\pi$-Elektronen der Doppelbindungen sind nicht an einen festen Ort gebunden. Da sie gleichmäßig über das Molekül verteilt sind, können sie zur nächsten Bindung klappen. Daher spricht man von delokalisierten $\pi$-Elektronen. Dies ist möglich, da sich Einfach- und Doppelbindungen abwechseln. Diese werden als konjugierte Doppelbindungen bezeichnet. Es gibt somit zwei mesomere Grenzstrukturen. Die wahre Struktur liegt irgendwo zwischen diesen Zuständen. Daher schreibt man die sechs delokalisierten $\pi$-Elektroden auch oft als Kreis in der Mitte des Sechsrings.
Diese Mesomerie hat einen stabilisierenden Effekt auf die Verbindung. Du kannst es dir so vorstellen, dass ein Elektron, bevor es eine Reaktion eingehen kann, einfach wegklappt und sich so an einem anderen Ort befindet. Benzol ist bei Raumtemperatur eine farblose, klare Flüssigkeit. Es ist giftig und krebserregend. Seine Dichte ist mit 0,88 $\frac{kg}{l}$ etwas geringer als die von Wasser. Benzol ist recht unpolar. Es ist in organischen Lösemitteln wie Ether und Alkoholen gut löslich. In Wasser dagegen ist die Löslichkeit sehr gering. Es ist brennbar und verbrennt mit gelber, stark rußender Flamme. Das ist ein Hinweis auf den hohen Kohlenstoffanteil im Molekül.
Eine typische Reaktion des Benzols ist die elektrophile Substitution. Da das Benzolmolekül aber sehr stabil ist, muss es mithilfe einer starken Lewis-Säure aktiviert werden. Kommt ein zweiter Substituent dazu, kann dieser an unterschiedlichen Stellen des Rings angelagert werden. Dies wird immer im Vergleich zum ersten Substituenten gesehen. Die ortho-Stellung ist genau eines der beiden C-Atome neben dem ersten Substituenten. Die meta-Stellung bezeichnet den Substituenten am zweiten C-Atom und bei der para-Stellung liegen sich die Substituenten genau gegenüber am Ring. Benzol kommt vor allem in Steinkohle und Erdöl vor. Es entsteht aber auch bei unvollständigen Verbrennungen. Dies ist z.B. der Fall bei Hausbränden und Zigaretten. Das meiste Benzol, das in die Atmosphäre gelangt, stammt aber von Autoabgasen.

Verwendet wurde Benzol lange Zeit als Lösemittel. Aufgrund seiner Gefährlichkeit wird darauf heute verzichtet und Alternativen, wie Xylol und Toluol, werden eingesetzt. Große Bedeutung hat Benzol nach wie vor für chemische Synthesen. Es dient durch Modifikationen als Ausgangsstoff für viele chemische Produkte.
Phenol
Phenol ist eine Verbindung, die sich aus dem Benzol ableitet, und somit ein Aromat. Benzol ist hier mit einer Hydroxy-Gruppe substituiert. Durch die Hydroxy-Gruppe ist die Ausbildung einer Wasserstoffbrückenbindung zwischen den Molekülen möglich. Dadurch sind Siede- und Schmelztemperatur im Vergleich zum Benzol deutlich erhöht. Phenol ist kein Alkohol, sondern eine schwache Säure. Der Grund dafür liegt in der Stabilisierung des Phenolat-Ions.
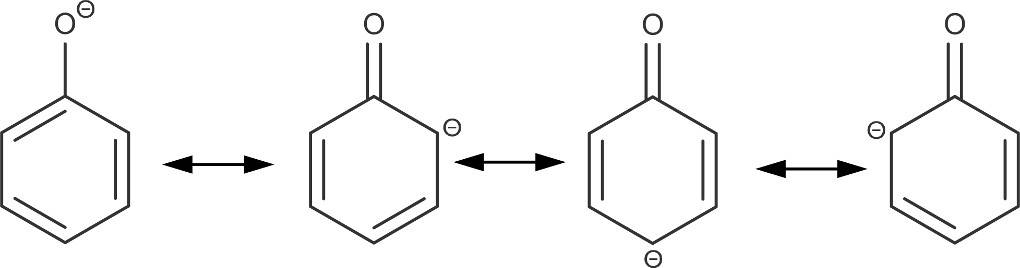
Die negative Ladung kann in den Ring hinein wandern. Sie ist wie die anderen $\pi$-Elektronen delokalisiert und damit über das Molekül verteilt. Das Ion ist somit stabiler als das ungeladene Molekül.
Auch Phenol geht elektrophile Substitutionen ein. Die delokalisierte Ladung des Phenolat-Ions dirigiert dabei weitere Substituenten in die ortho- oder para-Stellung. Früher wurde Phenol als Antiseptikum in der Medizin angewandt. Aufgrund seiner ätzenden Eigenschaft wurde es aber bald durch andere Stoffe abgelöst. Außerdem fand es Verwendung als Unkrautvernichter und zur Synthese von Kunstharzen.
Alle Videos zum Thema
Videos zum Thema
Benzol, Phenol und andere Aromaten (10 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Benzol, Phenol und andere Aromaten (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung













 Benzol
Benzol
 Benzol – Umwelt- und Gesundheitsaspekte
Benzol – Umwelt- und Gesundheitsaspekte
 Alkanole und Phenole
Alkanole und Phenole
 Alkanole und Phenole – Eigenschaften und Reaktionen
Alkanole und Phenole – Eigenschaften und Reaktionen
 Mehrwertige Alkohole und Phenole
Mehrwertige Alkohole und Phenole
 Chinone – Struktur
Chinone – Struktur
 Chinone – Redoxverhalten
Chinone – Redoxverhalten









