Trennverfahren
Um Stoffgemische in ihre Reinstoffe zu trennen, braucht man Trennverfahren. Diese nutzen die unterschiedlichen Stoffeigenschaften der Komponenten eines Gemisches aus.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Trennverfahren im Überblick
Trennverfahren werden immer dann angewandt, wenn bestimmte Stoffe aus einem Stoffgemisch entfernt werden sollen. Das ist wichtig beim Recycling und bei der Reinigung von Stoffen.
Es gibt verschiedene Arten von Stoffgemischen. Dabei ist es bedeutsam, welche Aggregatzustände die Bestandteile der Stoffgemische aufweisen. So gibt es zum Beispiel fest-flüssige, flüssig-flüssige und gasförmig-flüssige Stoffgemische. Aber auch Stoffgemische in Feststoffen sind möglich. Die Art des Stoffgemisches ist wichtig für die Entscheidung über das geeignete Trennverfahren.

Wo begegnet uns die Anwendung des chemisches Trennverfahrens im Alltag? Wenn wir etwas Bestimmtes aus einer größeren Menge heraussuchen, ist dies bereits ein Trennverfahren. Das Auslesen und das Sortieren gehören zu den einfachsten Trennverfahren. Hierbei macht man sich die unterschiedliche Größe der Objekte zu Nutze.
Es gibt noch viele andere Trennverfahren. Hier soll dir ein kleiner Einblick gegeben werden. Das Filtrieren und Dekantieren dient der Trennung eines Feststoffs von einer Flüssigkeit, wenn sie sich nicht miteinander mischen. Auch das Sedimentieren wird für diese Stoffgemische eingesetzt. Dabei setzt sich mit der Zeit der Feststoff am Boden ab, da er eine höhere Dichte aufweist als die Flüssigkeit.
Das Eindampfen dient der Trennung von gelösten Feststoffen aus einem flüssigen Lösungsmittel. Dabei wird das Lösungsmittel so lange erhitzt, bis es vollständig verdunstet ist. Zurück bleibt der gelöste Feststoff, da dieser einen viel höheren Schmelzpunkt als das Lösemittel besitzt.
Mit dem Trennverfahren der Destillation ist es möglich flüssig-flüssige Stoffgemische zu trennen. Das Extrahieren wird z.B. benutzt, um gelöste Stoffe aus einer Flüssigkeit zu entfernen. Dabei spielt die Löslichkeit des gelösten Stoffs eine wichtige Rolle. Eine weitere wichtige Methode der Trennung von Stoffgemischen in der Chemie ist die Chromatografie.
Filtrieren und Dekantieren
Die Trennverfahren Filtrieren und Dekantieren werden eingesetzt, um heterogene Stoffgemische aus Feststoffen und Flüssigkeiten zu trennen. Dem Dekantieren geht eine Sedimentation voraus. Dabei setzt sich der Feststoff am Boden des Gefäßes ab. Nun kann die Flüssigkeit, die sich über dem Feststoff befindet, vorsichtig abgegossen werden. Dieses Abgießen wird als Dekantieren bezeichnet. Dabei wird wahrscheinlich wieder etwas Feststoff aufgewirbelt. Um eine gute Trennung zu erhalten, muss der Feststoff erneut sedimentieren und dann kann wieder dekantiert werden. Mit dieser Methode lässt sich das Gemisch meist nicht vollständig trennen. Es bleibt etwas Flüssigkeit am Feststoff zurück.

Um die Trennleistung zu erhöhen, kann man die Methode der Filtration anwenden. Bei dieser Trennmethode wird der Feststoff durch einen Filter zurückgehalten, während die Flüssigkeit ungehindert hindurchfließen kann.
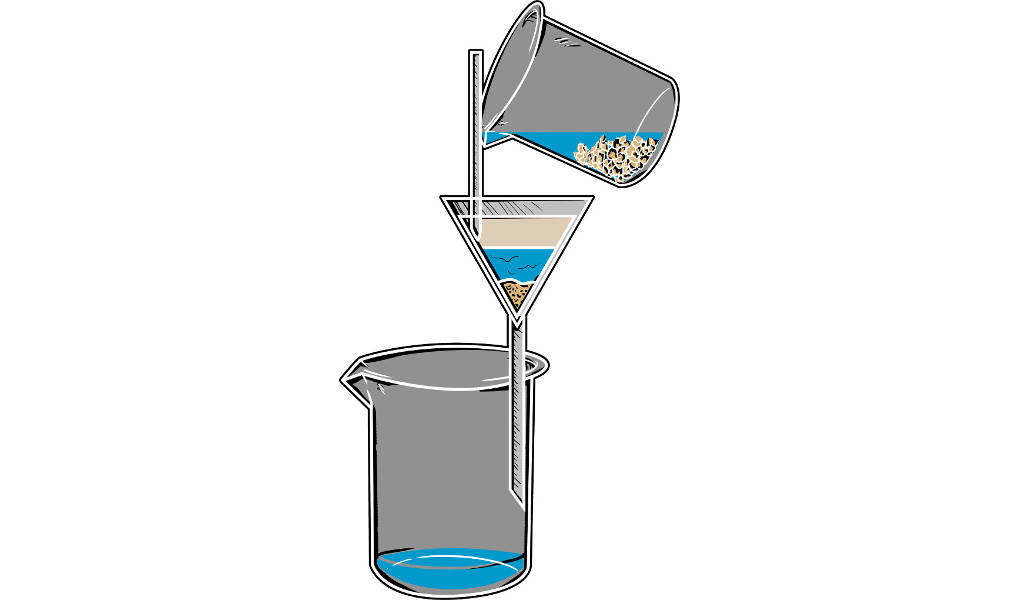
Um gefällte Niederschläge aus einer Lösung abzutrennen, kann dieses Verfahren genutzt werden. Es ist dir im Chemieunterricht vielleicht schon begegnet.
Destillation
Die Destillation wird genutzt, um Flüssigkeiten, die ineinander löslich sind, voneinander zu trennen. Aber auch die Trennung eines fest-flüssigen Gemisches ist mit diesem Verfahren möglich. Um zwei Flüssigkeiten zu trennen, müssen ihre Siedepunkte weit genug voneinander entfernt liegen. Das Gemisch wird dann auf die Siedetemperatur des Stoffes gebracht, der die niedrigste Siedetemperatur im Gemisch aufweist.
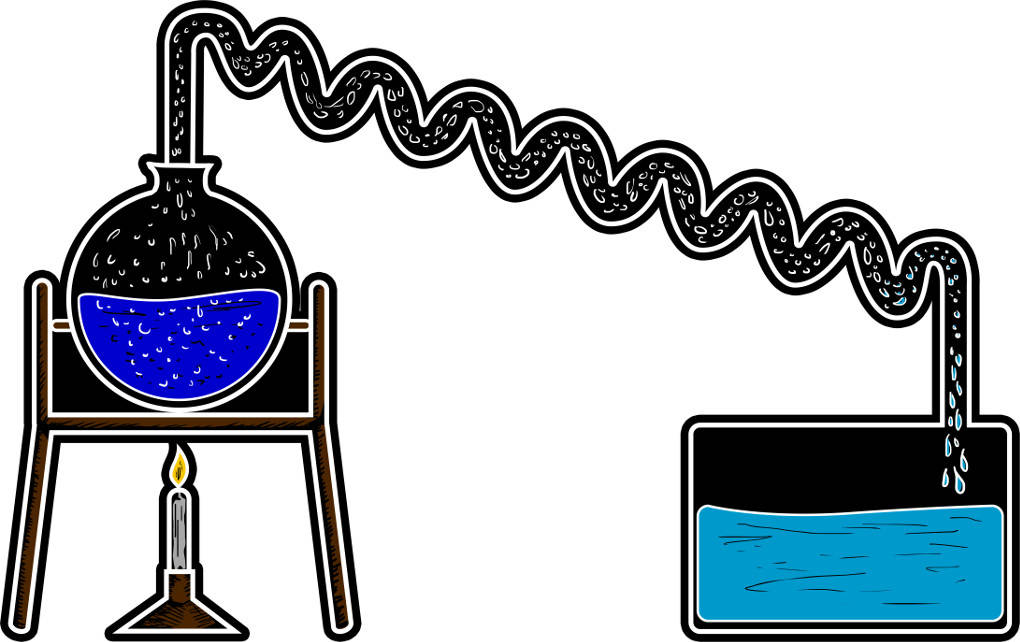
Während des Siedevorgangs steigt die Temperatur nicht. Die Energie wird nur für die Änderung des Aggregatzustandes aufgewendet. Erst danach steigt die Temperatur wieder. Der verdampfte Stoff wird in eine Kühlung geleitet. Dort kondensiert es wieder und kann als gereinigte Flüssigkeit aufgefangen werden. Die Destillation kann z.B. bei der Trennung von Alkohol und Wasser angewendet werden. Es gibt eine besondere Form der Destillation zur Trennung der Bestandteile: die fraktionierte Destillation bei Erdöl.
Chromatografie
Die Chromatografie ist ein Trennverfahren das große Bedeutung für die analytische Chemie besitzt. Mithilfe dieser Methode kann ein Stoffgemisch aus mehreren Komponenten aufgetrennt werden, so dass die einzelnen Bestandteile erkennbar werden. So können unbekannte Stoffgemische untersucht und aufgeklärt werden. Es handelt sich bei diesem Verfahren um eine qualitative Methode. Man kann also Aussagen über die Zusammensetzung treffen, aber keine über die Konzentrationen der Stoffe.
Es gibt einige Arten der Chromatografie. Sie haben aber bestimmte Gemeinsamkeiten. Es gibt eine mobile und eine stationäre Phase. Die mobile Phase ist das Lösungsmittel, auch als Laufmittel bezeichnet. Es muss in der Lage sein, das zu untersuchende Stoffgemisch zu lösen. Die Polarität spielt daher eine wichtige Rolle.
Das Laufmittel transportiert das Stoffgemisch dann durch die stationäre Phase. Auch hier ist die Polarität wieder entscheidend. Die Bestandteile des Gemisches wechselwirken aufgrund der unterschiedlichen Polaritäten verschieden stark mit der stationären Phase. Dadurch bewegen sie sich unterschiedlich schnell darauf fort. Durch diesen Effekt kommt die Trennleistung der Chromatografie zustande.
Ein sehr bekanntes Verfahren ist die Dünnschichtchromatografie (DC). Daneben gibt es aber auch noch andere Formen. Das sind die Säulenchromatografie, die Gaschromatografie, die Hochleistungsflüssigkeitschromatografie und die Ionenaustauschchromatografie. All diese Trennverfahren sind wichtige Anwendungen der analytischen Chemie.
Alle Videos zum Thema
Videos zum Thema
Trennverfahren (11 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Trennverfahren (10 Arbeitsblätter)
-
 Trennverfahren im Überblick
PDF anzeigen
Trennverfahren im Überblick
PDF anzeigen -
 Trennverfahren – Filtrieren und Dekantieren
PDF anzeigen
Trennverfahren – Filtrieren und Dekantieren
PDF anzeigen -
 Trennverfahren – Destillation
PDF anzeigen
Trennverfahren – Destillation
PDF anzeigen -
 Trennverfahren – Chromatografie
PDF anzeigen
Trennverfahren – Chromatografie
PDF anzeigen -
 Adsorption an Oberflächen
PDF anzeigen
Adsorption an Oberflächen
PDF anzeigen -
 Dünnschichtchromatografie
PDF anzeigen
Dünnschichtchromatografie
PDF anzeigen -
 Säulenchromatographie
PDF anzeigen
Säulenchromatographie
PDF anzeigen -
 Gaschromatografie
PDF anzeigen
Gaschromatografie
PDF anzeigen -
 Hochleistungsflüssigkeitschromatographie (HPLC)
PDF anzeigen
Hochleistungsflüssigkeitschromatographie (HPLC)
PDF anzeigen -
 Ionenaustauschchromatographie
PDF anzeigen
Ionenaustauschchromatographie
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung






















