Thioester und Ester der Phosphorsäure
- Thioester und Ester der Phosphorsäure
- Vergleich von Estern und Thioestern
- Herstellung und Funktion von Thioestern
- Die Rolle von Thioestern
- Phosphorsäureester
- Phosphorsäureanhydride und Energiespeicherung
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Lerntext zum Thema Thioester und Ester der Phosphorsäure
Thioester und Ester der Phosphorsäure
Thioester und Ester sind essenzielle Moleküle in der Chemie und Biochemie. Beide Verbindungen enthalten eine Acylgruppe, doch ihre unterschiedlichen chemischen Eigenschaften machen sie zu Schlüsselspielern in verschiedenen biologischen Prozessen. Diese Unterschiede – vor allem in ihrer Reaktivität – bestimmen, wo und wie sie im Stoffwechsel und in der Zellstruktur vorkommen. Dieser Text führt von den Unterschieden zwischen Estern und Thioestern über ihre spezifische Rolle in der Acylgruppenübertragung bis hin zur Bedeutung von Phosphorsäureestern in Zellmembranen und im Energiestoffwechsel.
Vergleich von Estern und Thioestern
Der Vergleich zwischen Estern und Thioestern bietet eine natürliche Ausgangsbasis, um ihre strukturellen und funktionellen Unterschiede zu beleuchten.
-
Strukturelle Unterschiede:
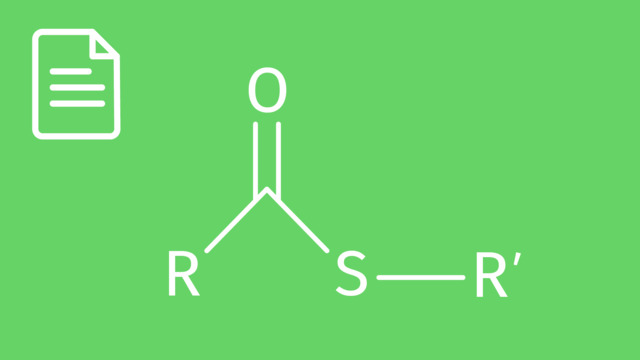
Ester bestehen aus einer Acylgruppe $\ce{R-CO}$ und einer Sauerstoffbrücke $\ce{-O-}$, während Thioester eine Schwefelbrücke $\ce{-S-}$ besitzen. Diese kleine Veränderung hat weitreichende Folgen für ihre chemische Reaktivität. Hier siehst du die Darstellung eines Esters und eines Thioesters.

Chemische Reaktivität:
Thioester sind aufgrund des Schwefels reaktiver als Ester. Die schwächere Bindung zwischen Kohlenstoff und Schwefel führt dazu, dass Thioester schneller hydrolysiert werden und in biochemischen Reaktionen besser als Acylgruppentransporter fungieren. Ester hingegen sind stabiler und widerstandsfähiger gegenüber spontanen chemischen Reaktionen.Biologische Funktion:
Die Stabilität von Estern macht sie zu idealen Speicherformen, beispielsweise in Form von Fetten (Triglyceriden). Thioester hingegen eignen sich durch ihre Reaktivität besonders für Prozesse, bei denen rasche Reaktionen wichtig sind, wie etwa bei der Fettsäuresynthese oder im Citratzyklus.
Die unterschiedlichen chemischen Eigenschaften von Estern und Thioestern erklären, warum sie in verschiedenen biologischen Kontexten vorkommen. Während Ester eine Speicherfunktion haben, werden Thioester in dynamischen Stoffwechselprozessen verwendet.
Herstellung und Funktion von Thioestern
Thioester entstehen durch die Reaktion von Carbonsäuren mit Thiolen. Ihre Reaktivität ermöglicht es ihnen, als hochenergetische Zwischenprodukte in Stoffwechselwegen zu fungieren.
Herstellung von Thioestern:
Die Reaktion zwischen einer Carbonsäure $\ce{R-COOH}$ und einem Thiol $\ce{R’-SH}$ führt zur Bildung eines Thioesters $\ce{R-CO-S-R’}$. Aufgrund des Schwefels sind Thioester anfälliger für Reaktionen wie Hydrolyse oder die Übertragung von Acylgruppen.Biologische Bedeutung:
Ein prominentes Beispiel für einen biologisch wichtigen Thioester ist Acetyl-CoA. Es ist das zentrale Molekül in vielen Stoffwechselprozessen, darunter die Fettsäuresynthese und der Citratzyklus. Die Reaktivität des Thioesters ermöglicht die effiziente Übertragung von Acylgruppen, die für den Zellstoffwechsel unverzichtbar ist. Die höhere Reaktivität von Thioestern bereitet den Boden für ihre zentrale Rolle in der Acylgruppenübertragung, die im nächsten Abschnitt detailliert betrachtet wird.
Die Rolle von Thioestern
Thioester sind besonders für die Übertragung von Acylgruppen geeignet, da sie reaktiver sind als Ester. Dies ist entscheidend für biochemische Prozesse, die einen schnellen Transfer von Acylgruppen erfordern.
Acetyl-CoA und Acylgruppenübertragung:
Acetyl-CoA, ein Thioester, ist das zentrale Molekül für die Acylgruppenübertragung in der Zelle. Es spielt eine Schlüsselrolle bei der Synthese von Lipiden und der Energiegewinnung im Citratzyklus.Acetylcholin und Nervenimpulse:
Acetylcholin, ein wichtiger Neurotransmitter, wird durch die Übertragung einer Acetylgruppe von Acetyl-CoA auf Cholin synthetisiert. Diese schnelle Acylgruppenübertragung ermöglicht die Bildung von Acetylcholin, das für die Signalübertragung an neuromuskulären Synapsen verantwortlich ist.
Die hohe Reaktivität von Thioestern wie Acetyl-CoA macht sie unverzichtbar für Prozesse wie die Neurotransmittersynthese. Diese Fähigkeit, Acylgruppen schnell zu übertragen, verbindet den Stoffwechsel direkt mit der neuronalen Funktion.
Phosphorsäureester
Neben den Carbonsäureestern spielen auch Phosphorsäureester eine zentrale Rolle in der Zellbiologie, insbesondere bei der Bildung von Membranen und der Energiespeicherung.
Phosphorsäuremono- und -diester: Phosphorsäure kann mit Alkoholen Monoester $\ce{H2PO4-}$ und Diester $\ce{HPO42-}$ bilden. Diese Phosphatgruppen sind negativ geladen und entscheidend für die Stabilität und Funktion von Molekülen wie ATP und DNA.
Lecithin und Zellmembranen: Ein Beispiel für ein biologisch wichtiges Phospholipid ist Lecithin, das als Hauptbestandteil der Zellmembranen fungiert. Lecithin ist amphipathisch, das heißt, es hat einen hydrophilen Kopf und einen hydrophoben Schwanz, was die Bildung der Lipid-Doppelschicht in Zellmembranen ermöglicht.
Phosphorsäureester wie die in Lecithin sind weniger reaktiv als Thioester, ihre Stabilität ermöglicht jedoch die Bildung von Zellstrukturen wie Membranen. Dadurch wirken sie als Schutzbarriere und steuern den selektiven Stofftransport in Zellen.
Phosphorsäureanhydride und Energiespeicherung
Phosphorsäureanhydride wie die in ADP und ATP speichern enorme Energiemengen. Diese Energiespeicherung ist entscheidend für zelluläre Prozesse, wie etwa die DNA-Synthese und den Transport von Stoffen durch Zellmembranen.
ADP und ATP:
ADP (Adenosindiphosphat) und ATP (Adenosintriphosphat) enthalten energiereiche Phosphorsäureanhydride. Die Energie wird freigesetzt, wenn die Phosphatgruppen hydrolysiert werden, was z. B. für die Muskelkontraktion oder DNA-Replikation genutzt wird.Schutz durch negative Ladungen:
Die negativen Ladungen der Phosphatgruppen schützen Moleküle wie ATP und DNA vor nicht enzymatischem Abbau. Dadurch bleiben sie stabil, bis Enzyme sie gezielt abbauen.
Phosphorsäureanhydride sind weniger reaktiv als Thioester, speichern jedoch Energie für biochemische Reaktionen. Durch ihre negativen Ladungen bleiben sie stabil und funktional, was wiederum die Rolle von Phosphorsäureestern in der Energiebereitstellung unterstreicht.
Zusammenfassung zum Thema Thioester und Ester der Phosphorsäure
- Thioester und Ester haben zwar ähnliche Strukturen, doch ihre unterschiedlichen Eigenschaften machen sie zu entscheidenden Akteuren in der Biologie.
- Während Thioester wie Acetyl-CoA hochreaktiv sind und schnelle Reaktionen im Stoffwechsel unterstützen, dienen stabilere Ester als Speicherfunktion der Fette.
- Phosphorsäureester, wie sie in ATP und Lecithin vorkommen, zeigen die chemische Vielfalt und Funktionalität dieser Verbindungen, indem sie Energie speichern und Zellmembranen bilden. Durch die Verknüpfung der chemischen Eigenschaften von Estern, Thioestern und Phosphorsäureestern mit ihrer biologischen Funktion zeigt sich, wie die chemische Struktur die Funktion im Leben bestimmt. Jede dieser Verbindungen erfüllt, abhängig von ihrer Reaktivität und Stabilität, eine spezielle Aufgabe im komplexen Zusammenspiel des Lebens.
Häufig gestellte Fragen zum Thema Thioester und Ester der Phosphorsäure
Thioester und Ester der Phosphorsäure Übung
-
Bezeichne die organischen Moleküle.
TippsDie funktionellen Gruppen geben Aufschluss darüber, welcher Stoffklasse das Molekül angehört.
Ein Ester und ein Thioester unterscheiden sich dadurch,dass das Sauerstoffatom der Estergruppe durch ein Schwefelatom ersetzt wurde.
LösungDie korrekte Nomenklatur in der organischen Chemie ist sehr wichtig. Ebenfalls damit geht einher, dass man die entsprechenden Moleküle mittels einer Struktur- oder Halbstrukturformel benennen kann. In dem gewählten Beispiel geht es darum, dass man in einer Halbstrukturformel die organischen Stoffklassen erkennt und richtig zuordnet.
Die einfachste Stoffklasse hier ist der Alkohol, der die Endung -OH besitzt. Etwas komplexer ist die Carbonsäure (COOH). Sie besitzt ein acides Wasserstoffatom, welches abgegeben werden kann und somit liegt eine deprotonierte Carbonsäure vor. Die für diese Übung relevanten Stoffklassen sind jedoch die Ester und Thioester. Wenn man eine Carbonsäure gemeinsam mit einem Alkohol in einer Kondensationsreaktion reagieren lässt, so erhält man einen Ester (-COO-R). R bedeutet hierbei ein beliebiger organischer Rest. Nimmt man statt eines Alkohols ein Thioalkohol (-SH), so bildet sich der sogenannte Thioester (-COS-R).
-
Gib die reaktionsspezifischen Eigenschaften zum Thioester und Ester an.
TippsStabile Gruppen sind meist gute Abgangsgruppen.
Thioester sind leichter hydrolisierbar als Ester.
LösungZwischen normalen Estern und den sogenannten Thioestern, bei denen der Ester-Sauerstoff durch ein Schwefelatom ersetzt wurde, gibt es trotz ihrer augenscheinlichen Ähnlichkeit der Molekülbauweise zahlreiche Unterschiede:
Thioester spielen bei vielen Stoffwechselprozessen im menschlichen Körper eine wichtige Rolle. Die Bildung der Thioester ist energetisch eher wenig bevorzugt, sodass die Hydrolyse sehr viel Energie liefert. Der Energieinhalt der Thioester kann also als höher eingestuft werden. Ebenfalls ist die Thioestergruppe eine stabilere Gruppe als die Estergruppe und kann so auch besser als Abgangsgruppe fungieren. Die Hydrolyse hängt ebenfalls mit dieser Eigenschaft zusammen.
-
Erkläre die Reaktion zum Thioester.
TippsEine Gleichgewichtsreaktion kann durch das Entfernen eines Reaktionspartners bzw. eines Produktes in die gewünschte Richtung verschoben werden, wie im MWG beschrieben.
Statt einer Carbonsäure kann man auch Acetylchlorid benutzen. Eine starke Säure entsteht bei der Reaktion anstatt des Wassers.
Wenn Wasser abgespalten wird, redet man von einer Kondensationsreaktion.
LösungDie Synthese eines Thioesters ist weitestgehend äquivalent zur Herstellung eines normalen Esters. Man benötigt eine Carbonsäure sowie einen (Thio)Alkohol. Unter Kondensation, der Abspaltung von Wasser, entsteht nun der jeweilige (Thio)Ester. Dies ist das gewünschte Produkt. Die Reaktion liegt jedoch als Gleichgewichtsreaktion vor, sodass kleine Teile vom Ester und Wasser wieder zu den Edukten reagieren. Dies kann durch das Entfernen von Wasser als Produkt unterbunden werden, da dadurch das MWG auf die rechte, die Produktseite, geschoben wird. Eine Säure wird als Katalysator eingesetzt.
Statt einer Carbonsäure kann auch Carbonsäurechlorid benutzt werden. Hier bietet sich das Acetylchlorid an, welches mit einem Thiol mit beliebiger restlicher Kettenlänge zu dem entsprechenden Thioester sowie Chlorwasserstoff reagiert. In unserem Beispiel wäre die korrekte Reaktionsgleichung:
Acetylchlorid reagiert mit Propanthiol zu Ethylthioacetat (Thioester) und Chlorwasserstoff.
-
Benenne das Acetylcholin mit systematischem Namen.
TippsZur Erinnerung die Struktur von Acetylcholin:
Sulfoniumsalze sind die Stickstoffäquivalente mit Schwefel.
Ein positiv geladenes Stickstoffatom (${ N }^{ + }-R_{ 4 }$) nennt man Ammonium. Dies leitet sich davon ab, dass es die konjugierte Säure zum Ammoniak ist.
Die Acetoxy-Gruppe leitet sich von der Essigsäure ab und besitzt im Gegensatz zu der Acetylgruppe ein Sauerstoffatom mehr.
LösungDas Acetylcholin ist ein sehr wichtiger Botenstoff und Neurotransmitter im menschlichen Körper. Der Stoff liegt als quartäres Ammoniumsalz vor. Quartär meint, dass der Stickstoff vier verschiedene Reste besitzt und positiv geladen ist. Nun gibt es zwei verschiedene Namen, die nach der systematischen Benennung zutreffen.
(2-Acetoxyethyl)trimethylammonium
Das Trimetyhlammonium wird normal benannt. Besonderheit bei dieser Benennung ist die Acetoxy-ethyl-Gruppe. Die Acetoxygruppe bezeichnet die Acetylgruppe mit einem zusätzlichen Sauerstoffatom, also die Estergruppe. Da zwischen dem Sauerstoff- und Stickstoffatom noch Kohlenstoffe sind, muss die Endung "ethyl" dahinter gesetzt werden.
(2-(Trimethylammonium)ethyl)acetat
Diese Benennung ist simpler. Zuerst wird der Ammoniumteil benannt, danach das Ethyl zwischen Sauerstoff und Stickstoff. Zuletzt wird der Rest als Acetat, als Ableger der Essigsäure klassifiziert.
-
Beschreibe die Eigenschaften des Acetylcholins auf die Stoffwechselprozesse im Körper.
TippsAcetylcholinausschüttung ist nützlich beim Lernen und lässt das Herz langsamer schlagen.
Mit Stoffwechsel, Verdauung und Prozessen dieser Art hat das Acetylcholin nichts zu tun.
LösungDas Acetylcholin ist einer der wichtigsten Neurotransmitter in Organismen und für zahlreiche Vorgänge im Körper verantwortlich. Acetylcholin ist ein Ester des einwertigen Alkohols Cholin und der Essigsäure.
Im Körper erfüllt es die Funktion, die Herzfrequenz zu vermindern. Das Herz ist kein glatter Muskel, dennoch kontrolliert das Acetylcholin auch die Kontraktion der glatten Muskulatur. Weiterhin ist Acetylcholin ein wichtiger Transmitter, der als Botenstoff für zahlreiche kognitive Prozesse funktioniert. Es unterstützt so Lern- und Gedächtnisvorgänge. Bei der allseits bekannten Krankheit Alzheimer liegt oftmals ein Mangel an Acetylcholin vor. Ebenfalls wichtig ist das Acetylcholin für die Sekretion exokriner Drüsen, wobei es hier wieder als Botenstoff fungiert.
-
Ordne die Abgangsgruppen nach ihrer Güte.
TippsGute Abgangsgruppen sind die konjugierten Basen starker Säuren, welche also sehr stabil sind.
Die Halogene sind in Ionenform stabil. Allerdings steigt ihre Stabilität äquivalent mit ihrer Säurestärke.
Je mehr die Ladung in größeren Molekülen delokalisiert werden kann, desto stabiler ist das Molekül als Abgangsgruppe.
Eine der schlechtesten Abgangsgruppen ist das Hydroxid-Ion.
LösungAbgangsgruppen entstehen bei chemischen, organischen Reaktionen, wobei eine funktionelle Gruppe meist durch eine andere ausgetauscht wird. Die Güte einer Abgangsgruppe wird sehr stark mit ihrem Verhalten, allein existieren zu kommen, gleichgesetzt. Stabile Ionen sind gute Abgangsgruppen, während instabile weniger gute sind. Als Faustregel gilt hier, dass die konjugierten Anionen starker Säuren meist schwache Basen, aber sehr stabil sind.
Schaut man auf die Tabelle, so müssen die Halogen-Ionen aufgrund ihrer Stabilität der vollen Außenschale als Ion an den ersten Platz gesetzt werden. Hier gilt jedoch, dass HI eine stärkere Säure als HCl ist, sodass das Iodid-Ion auch eine stabilere und somit bessere Abgangsgruppe darstellt. Des Weiteren weisen gute Abgangsgruppen die Möglichkeit auf, die negative Ladung über verschiedene Atome zu delokalisieren. Hier ist das Beispiel die Sulfatgruppe. Die negative Ladung ist über drei verschiedene Sauerstoffatome zu verteilen, wodurch das Molekül an Stabilität gewinnt. Die Estergruppe hat diese Möglichkeit nicht, wodurch sie eine schlechte Abgangsgruppe darstellt. Am schlechtesten ist jedoch das Hydroxid-Ion, solange man keine Möglichkeit hat, ein Proton hinzuzufügen, sodass sich Wasser bildet. Das Hydroxid-Ion am Alkohol hat am meisten Probleme, die Ladung auszugleichen, sodass es die schlechteste Abgangsgruppe darstellt.
9.711
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.342
Lernvideos
38.729
Übungen
33.706
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung





 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?