Aggregatzustände
Hier findest du die Definition zu Aggregatzuständen, welche unterschiedlichen Aggregatzustände es gibt und wie sie durch Druck und Temperatur beeinflusst werden.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Begriff Aggregatzustand
Mit dem Begriff Aggregatzustand werden die unterschiedlichen Zustände, die ein Stoff annehmen kann, beschrieben. Diese Zustände werden beeinflusst durch die Temperatur und den Druck. In welchem Aggregatzustand sich ein Stoff bei gegebener Temperatur und Druck befindet, kann in dem entsprechenden Phasendiagramm abgelesen werden.
Es gibt drei klassische Aggregatzustände. Diese sind fest, flüssig und gasförmig.

Grundsätzlich gilt, dass im Feststoff die kinetische Energie am geringsten und die Ordnung der Teilchen am größten ist. In einem Gas ist dagegen die kinetische Energie am größten und die Ordnung am geringsten. Flüssigkeiten befinden sich bei diesen Größen in der Mitte.
In der Physik sind weitere Aggregatzustände bekannt. Ein Beispiel ist das Plasma. Dabei handelt es sich um ionisiertes Gas mit ganz eigenen Eigenschaften.
Feststoffe
Feststoffe besitzen eine feste, definierte Form. Außerdem besitzen sie ein festes Volumen. Wie können diese Eigenschaften des festen Aggregatzustands erklärt werden?
Dafür bedient man sich des Teilchenmodells. Dabei nimmt man an, dass Stoffe aus mikroskopischen Teilchen bestehen, die nicht mehr teilbar sind. Diese werden vereinfacht als Kugeln dargestellt. Für einen Feststoff sieht das Teilchenmodell wie folgt aus.
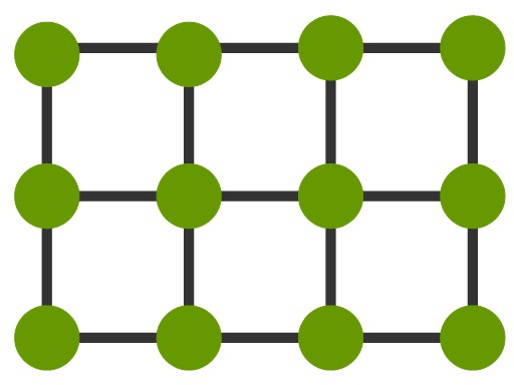
Du kannst erkennen, dass die Teilchen hier sehr geordnet vorliegen. Sie liegen eng zusammen und sind in einem Gitter angeordnet. Durch die große Nähe sind die Anziehungskräfte zwischen den Teilchen hoch.
Diese Kräfte werden als Kohäsions- und auch als Van-der-Waals-Kräfte bezeichnet. Durch diese Kräfte werden die Teilchen an ihrem Platz gehalten. Sie können sich nicht frei bewegen, sondern nur an ihrem Platz schwingen.
Wird nun Energie in Form von Wärme dem Feststoff zugeführt, nimmt die kinetische Energie der Teilchen zu. Sie schwingen mit steigender Temperatur immer stärker. Irgendwann ist ein kritischer Punkt erreicht an dem die Anziehungskräfte der Schwingung nicht mehr standhalten können und das Gitter zerbricht. Dies ist der Vorgang des Schmelzens. Der Übergang in die entgegengesetzte Richtung wird Erstarren oder Gefrieren genannt. Im Teilchenmodell kann man den Übergang vom festen in den flüssigen Aggregatzustand wie folgt darstellen.
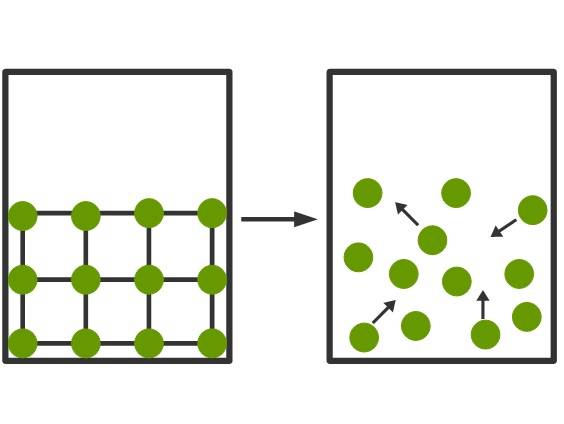
Flüssigkeiten
Mit dem Schmelzen ist der flüssige Aggregatzustand erreicht. Damit besitzt der Stoff nun keine feste Form mehr aber ein festes Volumen. Die Flüssigkeit nimmt die Form des Gefäßes an, in dem sie sich befindet. Das Volumen verändert sich allerdings nicht wenn es in ein anderes Gefäß gegeben wird.
In einer Flüssigkeit besitzen die Teilchen eine höhere kinetische Energie als in einem Feststoff. Sie bewegen sich also deutlich schneller. Sie können sich frei bewegen, sind aber immer noch relativ dicht zusammen, so dass die Anziehungskräfte in gewissem Ausmaß wirken können.
An der Oberfläche einer Flüssigkeit kommt es dazu, dass die Teilchen mit der höchsten kinetischen Energie die Flüssigkeit verlassen und in die Gasphase eintreten. Diesen Vorgang nennt man Verdunstung. Dabei nimmt die Energie der Flüssigkeit insgesamt ab, da die Teilchen mit niedriger kinetischer Energie in der Flüssigkeit zurückbleiben. Dadurch entsteht der Effekt der Verdunstungskälte, den z.B. der Mensch beim Schwitzen zum Abkühlen nutzt.

Die andere Möglichkeit des Übergangs vom flüssigen in den gasförmigen Zustand ist das Verdampfen. Dafür muss der Siedepunkt erreicht sein. Dies ist die Temperatur, bei der die kinetische Energie der Teilchen zu groß ist, als das sie noch in ihrem festen Volumen zusammenhalten können. Der Übergang vom Gas zur Flüssigkeit ist das Kondensieren. Im Teilchenmodell kann man die Verdampfung folgendermaßen veranschaulichen.
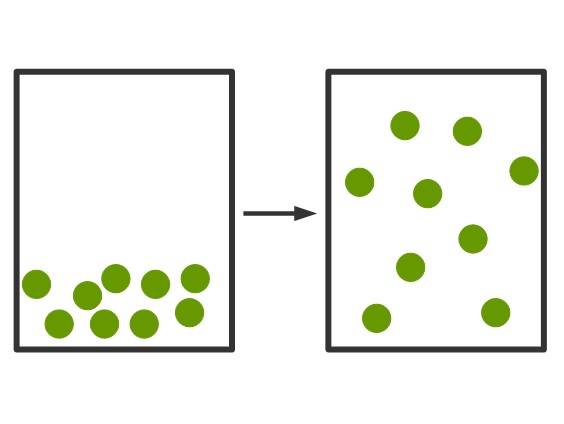
Gase
Im gasförmigen Zustand sind die Teilchen nun noch weiter auseinander gerückt und besitzen eine sehr hohe kinetische Energie. Dadurch sind die Kräfte die zwischen ihnen wirken äußerst gering. Gase besitzen keine feste Form und kein festes Volumen. Sie sind kompressibel, d.h., sie können durch Veränderung des Drucks ausgedehnt oder zusammengepresst werden. Innerhalb eines Gases ist es sehr chaotisch.
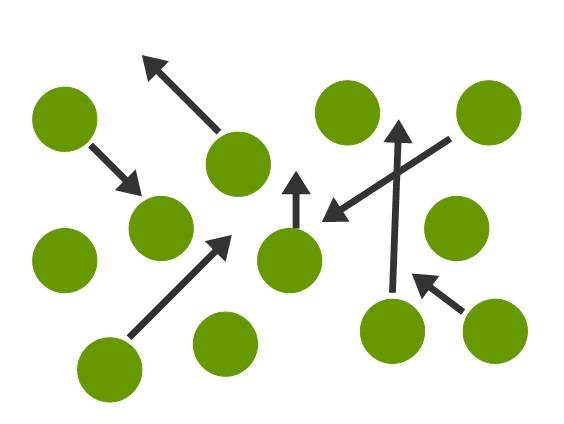
Berechnungen zu einem Gas können mithilfe des idealen Gasgesetzes angestellt werden. So kann man besipielsweise das Volumen des Gases bei einer gegebenen Temperatur und Druck berechnen.
Ein Gas kann auch den flüssigen Aggregatzustand überspringen und sich in einen Feststoff umwandeln. Diesen Vorgang nennt man Resublimation. Der umgekehrte Vorgang ist die Sublimation. Sublimation und Resublimation kann man beispielsweise bei Iod beobachten.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Aggregatzustände (7 Videos, 5 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Aggregatzustände (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung














 Was ist ein Festkörper?
Was ist ein Festkörper?
 Änderung des Aggregatzustandes
Änderung des Aggregatzustandes
 Teilchen als Modell
Teilchen als Modell
 Flüchtige Stoffe – Verdampfen, Verdunsten, Sieden und Siedetemperatur
Flüchtige Stoffe – Verdampfen, Verdunsten, Sieden und Siedetemperatur
 Ideale Gase und Gasgesetz
Ideale Gase und Gasgesetz
 Feststoffe
Feststoffe
 Flüssigkeiten
Flüssigkeiten









