Ester
Wichtige Polymere des Alltags, Monomer, Polymer, Makromoleküle, Polymerisation, Esterverbindungen, Verseifung
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Ester in unserem Alltag
Die Gruppe der Ester finden sich nahezu überall in unserem Alltag. Sei es der betörende Duft einer Blume, der köstliche Geschmack eines Apfels oder der stechende Geruch beim Zusammenkleben von Papier, all dies sind Ester, genauer Fruchtester. Die meisten natürlichen, wie auch künstlichen Aroma- und Geschmacksstoffe unseres Alltags sind Fruchtester. Die Fruchtester werden aus diesem Grund auch häufig in der Lebensmittel- und Parfümindustrie eingesetzt.
Es gibt aber noch mehr Ester: Auch alle Fette, Öle und Wachse sind Esterverbindungen. Als Polymer Polyester trägst du Esterverbindungen als Kleidung auf deiner Haut oder nutzt sie als PE-Kunststoffe in deinem Alltag. Selbst das sehr reaktionsfreudige Nitroglycerin ist eine Esterverbindung. Du siehst: Ester sind sehr vielseitig.
Bei diesem Kuchen sorgen sie gleichsam für den Geschmack wie auch für die eindrucksvolle Beleuchtung.

Namensgebung
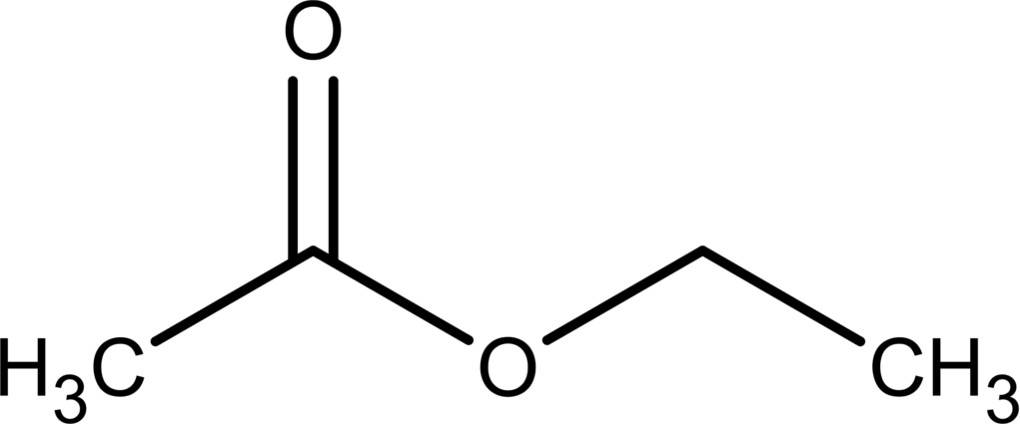
Der Begriff Ester bezeichnet eine organische Stoffklasse. Für den Namen der Stoffgruppe ist der „Essigäther“ verantwortlich. Hinter diesem alten Begriff steckt Essigsäure-Ethyl-Ester, auch Ethylacetat genannt. Ethylacetat zeigte die gleiche beruhigende und betäubende Wirkung wie der klassische „Äther“.
Esterbildung
Wie funktioniert die Esterbildung? Ester werden aus einem Alkohol und einer Säure gebildet. Dabei wird Wasser abgespalten. Es handelt sich also um eine Kondensationsreaktion. Allgemein kann man sich die folgende Wortgleichung einprägen.
$\text{Alkohol} + \text{Säure} \rightleftharpoons~\text{Ester} + \text{Wasser}$
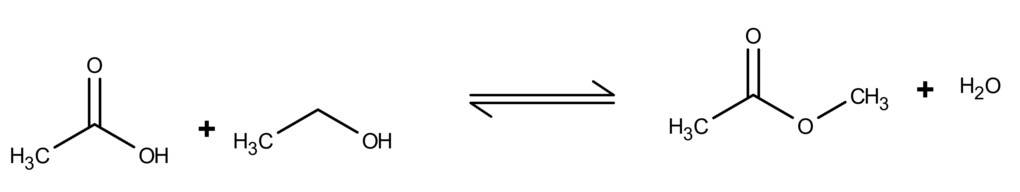
Reagiert die Hydroxy-Gruppe des Alkohols $(R_1-OH)$ mit der Carboxyl-Gruppe einer organischen Säure, einer Carbonsäure ($R_2-COOH$), bilden sich organische Carbonsäureester. Als Beispiel die Veresterung von Essigsäure und Ethanol zum Ethylacetat unter Abspaltung von Wasser:
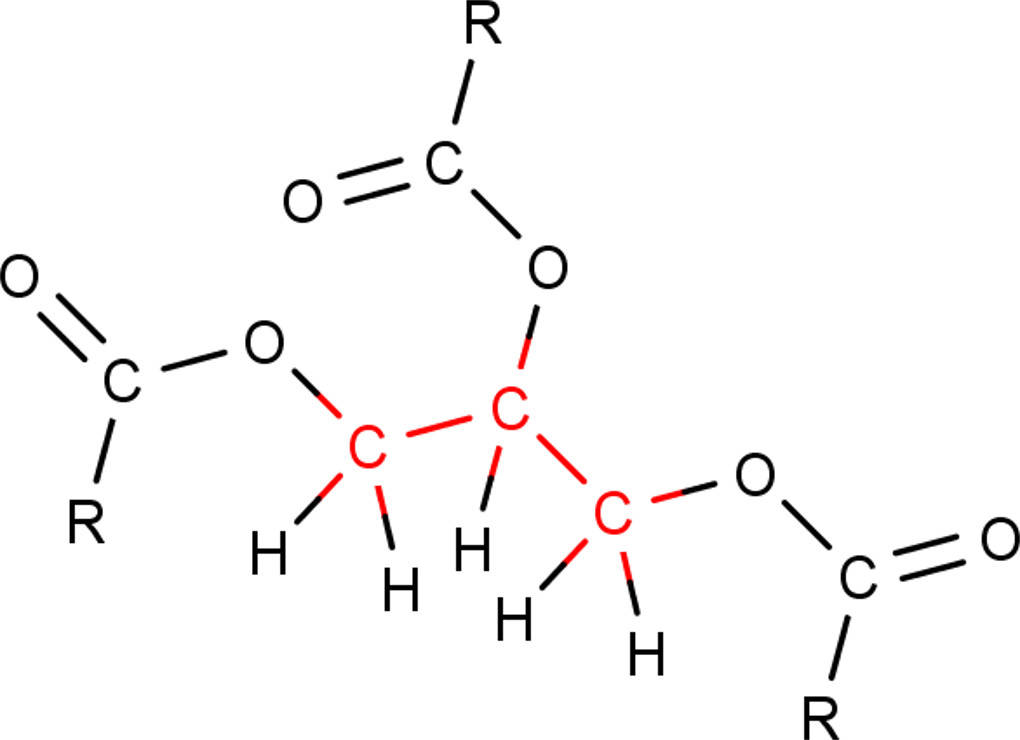
Auch Fette sind organische Carbonsäureester. Sie entstehen aus dem dreifachen Alkohol Glycerin und $3$ Fettsäuren.
Anorganische Esterverbindungen
Die Hydroxy-Gruppe $(-OH)$ des Alkohols kann sowohl mit organischen als auch mit anorganischen (mineralischen) Säuren reagieren. Reagieren Alkohole mit Mineralsäuren wie Schwefelsäure, Salpetersäure und Phosphorsäure, entstehen anorganische Ester. Unter diesen Mineralsäureestern findet man auch Nitroglycerin. Mit dem systematischen Namen heißt es richtig Trisalpetersäurepropan-1,2,3-triolester. Es wurde von Alfred Nobel, dem Stifter des Nobel-Preises, besser nutzbar gemacht als Dynamit.
Esterspaltung – Hydrolyse
Ester können aber auch gespalten werden. Die Hydrolyse wird unter Einsatz einer starken Säure als Katalysator durchgeführt. Dabei reagiert der Ester mit Wasser und es entstehen erneut Alkohol und Säure.
$CH_3COOCH_2CH_3 + H_2O \xrightarrow{H^+}~CH_3COOH + CH_3CH_2OH$
Eine andere Art der Esterspaltung ist die Verseifung. Diese wird mit einer Base durchgeführt. Dabei entsteht wieder ein Alkohol und das Kation der Base lagert sich an das Säurerestion an. Wenn die Verseifung mit einem Fett durchgeführt wird, entstehen Tenside. Dies sind Teilchen mit einem polaren Kopf und einem unpolaren Rest. Die lange Kohlenwasserstoffkette der Fettsäure bildet den unpolaren Schwanz, während das Carboxylat-Ion zusammen mit dem Kation der Base den polaren Kopf bildet. Sie werden z.B. in Seifen zum Lösen von Schmutz eingesetzt.
Estergleichgewicht
Die Esterbildung ist eine Gleichgwichtsreaktion.
$R_1-COOH + R_2-OH \rightleftharpoons~R_1-COO-R_2 + H_2O$
Das ist verdeutlicht durch die Gleichgewichtspfeile in der Reaktionsgleichung. Eine Gleichgewichtsreaktion stellt ein dynamisches Gleichgewicht dar, d.h., es laufen Hin- und Rückreaktion gleichzeitig ab. Das kann nur geschehen, da die Reaktion reversibel, also umkehrbar, ist. Eine Verbrennung kann z.B. keine Gleichgewichtsreaktion sein, da sie nicht reversibel ist. Das hängt einer zunehmenden Entropie zusammen.
Die Hin- und Rückreaktion laufen nicht zu jedem Zeitpunkt gleich schnell ab. Liegt das Gleichgewicht auf Seiten der Edukte läuft bevorzugt die Hinreaktion ab, hier also die Esterbildung. Zu einem bestimmten Zeitpunkt ist der Gleichgewichtszustand erreicht. An diesem Punkt ändern sich die Konzentrationen der Reaktionsteilnehmer nicht mehr. Die Reaktion kommt allerdings nicht zum Erliegen. Nur die Geschwindigkeiten der Hin- und Rückreaktion sind an diesem Punkt gleich.
Um nun die Ausbeute einer solchen Reaktion zu erhöhen, kann man sich des Prinzips von Le Chatelier bedienen. Dieser fand heraus, dass wenn ein Zwang auf ein im Gleichgewicht befindliches System ausgeübt wird, sich die Lage des Gleichgewichts so verschiebt, dass dem Zwang entgegengewirkt wird. Man kann ein Gleichgewicht mit der Temperatur, dem Druck und der Konzentration beeinflussen. Eine exotherme Reaktion, bei der ja Wärme frei wird, lässt sich durch eine niedrige Außentemperatur begünstigen und eine endotherme Reaktion folglich durch hohe Temperaturen.
Eigenschaften und weitere Anwendungen von Estern
Ester zeigen aufgrund ihrer Eigenschaften spezielle Anwendungen. Ester weisen aufgrund der eingebundenen Sauerstoffatome eine gewisse Polarität auf. Diese ist jedoch deutlich schwächer als die der Edukte dieser Ester. Bei langkettigen Estern ist die Polarität daher sehr schwach. Eine Ausbildung von Wasserstoffbrückenbindungen ist nicht möglich, da es kein Sauerstoff-gebundenes Wasserstoffatom gibt. Daher liegen die Schmelz- und Siedepunkte der Ester deutlich unter denen vergleichbar langer Alkohole oder Carbonsäuren. Organische Ester werden oft als Lösemittel eingesetzt. Beispiele dafür sind Ethyl- und Butylacetat. Diese kommen in Nagellackentferner sowie in Farben und Lacken zum Einsatz.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Ester (6 Videos, 4 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Ester (8 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung













 Ester
Ester
 Esterbildung und Hydrolyse
Esterbildung und Hydrolyse
 Estergleichgewicht
Estergleichgewicht
 Veresterung
Veresterung
 Versterung und Esterverseifung
Versterung und Esterverseifung
 Nitrocellulose
Nitrocellulose
 Thioester und Ester der Phosphorsäure
Thioester und Ester der Phosphorsäure
 Dynamit
Dynamit









