Katalyse und Katalysatoren
Den Katalysator kennst du bereits aus dem Auto, doch wie senkt er die Aktivierungsenergie herab und beschleunigt eine Reaktion?
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Was macht der Katalysator im Auto?
- Wirkungsweise von Katalysatoren
- Katalysatoren bei der chemischen Synthese
- Enzyme- Biokatalysatoren
Was macht der Katalysator im Auto?
Katalysatoren kennst du wahrscheinlich vom Auto. Der Katalysator dient dort zur Reinigung der Abgase. Aber wie kann der umgangssprachlich auch Kat genannte Katalysator das bewerkstelligen?
Ein Katalysator nimmt Einfluss auf chemische Reaktionen. Um das Auto anzutreiben, wird Benzin oder Diesel verbrannt. Es handelt sich also um eine Verbrennungsreaktion von mittellangen Kohlenwasserstoffen. Dabei entstehen vor allem Wasser und Kohlendioxid, aber durch unvollständige Verbrennung auch kurzkettige Kohlenwasserstoffe und Kohlenmonoxid sowie Schwefel- und Stickstoffverbindungen. Um diese umwelt- und gesundheitsschädigenden Stoffe zu entfernen bzw. zu reduzieren, wird der Katalysator eingesetzt. Dieser beschleunigt die Reaktionen, die diese Stoffe abbauen. Um das zu gewährleisten, besitzt der Katalysator eine sehr große Oberfläche, an der die Reaktion stattfinden kann.
Wirkungsweise von Katalysatoren
Wie genau ist die Wirkungsweise von Katalysatoren? Wie schafft ein Katalysator es aber, eine Reaktion zu beschleunigen? Einen Katalysator kannst du dir wie einen Bergführer vorstellen. Er führt dich über den niedrigsten Pass auf die andere Seite der Berge. Das Gebirgsmassiv ist im Fall einer Reaktion die Aktivierungsenergie. Das ist die Energie, die benötigt wird, um eine Reaktion zu starten. Der Katalysator geht Zwischenverbindungen ein, die eine niedrigere Aktivierungsenergie besitzen. Dadurch kommt die Reaktion schneller in Gang und läuft dadurch mit einer höheren Geschwindigkeit ab. Die Herabsetzung der Aktivierungsenergie kann in einem Diagramm wie folgt dargestellt werden:
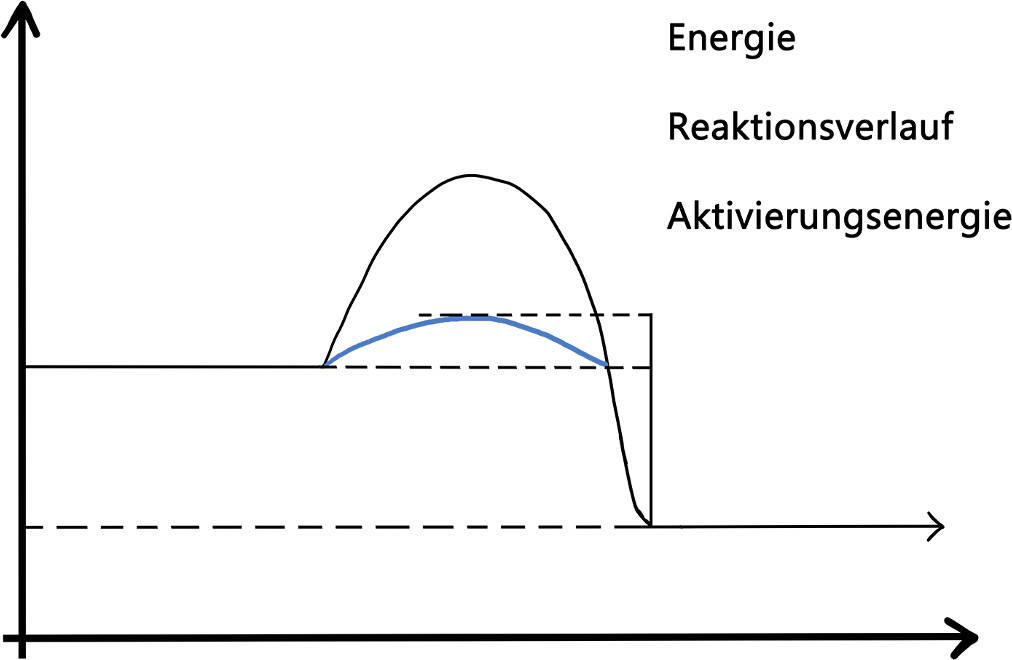
Der Katalysator liegt nach der Reaktion wieder unverbraucht vor. Er kann also wieder verwendet werden. Katalysatoren beschleunigen demnach eine Reaktion durch ihre Wirkungsweise. Sie verändern aber die chemische Reaktion und die Lage des Gleichgewichts nicht.
Katalysatoren bei der chemischen Synthese
Katalysatoren finden in der chemischen Industrie breite Anwendung. Sie werden benutzt , um in möglichst kurzer Zeit eine Große Menge eines Produkts herzustellen. So kann der Preis pro Kilogramm durch den Einsatz eines geeigneten Katalysators deutlich reduziert werden. Neben der Anwendung des Prinzips des kleinsten Zwangs (Le Chatelier) bieten Katalysatoren eine gute Möglichkeit den Ertrag zu steigern.
Verschiedene Reaktionen benötigen natürlich auch unterschiedliche Katalysatoren. Oft finden Metalloxide oder Metalle wie Platin und Titan Anwendung als Katalysator. Fast alle chemischen Produkte werden heutzutage mithilfe von Katalysatoren hergestellt. So sind wichtige Verfahren wie die Ammoniaksynthese und die Schwefelsäureherstellung katalysiert. Bei der Synthese von Ammoniak kommt ein $\alpha$ Eisen/Aluminiumoxid $(Al_2O_3)$ Katalysator zum Einsatz. Dabei muss trotzdem noch eine Temperatur von 450 bis 500 °C und ein Druck von 30 MPa herrschen, damit die Reaktion eine zufriedenstellende Ausbeute in angemessener Zeit ergibt. Die Schwefelsäureproduktion erfolgt mittels eines Vanadiumoxid-Katalysators $(V_2O_5)$. Schwefelsäure ist eine wichtige Grundchemikalie zur Herstellung von vielen weiteren Produkten wie Düngemittel und Sulfaten.
Enzyme- Biokatalysatoren
Katalysatoren sind auch für die chemischen Prozesse in Lebewesen unabdingbar. Viele der lebenswichtigen Stoffwechselprozesse sind durch Enzyme katalysiert. Diese Enzyme sind Eiweiße, die der Körper selbst herstellt. Enzyme haben einen engen Bereich, in dem sie optimal wirksam sein können. Aus diesem Grund ist es von essentieller Bedeutung, dass der Blut-pH und auch die Temperatur im Inneren des Körpers innerhalb bestimmter Grenzen verbleibt.
Alle Videos zum Thema
Videos zum Thema
Katalyse und Katalysatoren (4 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Katalyse und Katalysatoren (4 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung





 Wirkungsweise von Katalysatoren
Wirkungsweise von Katalysatoren
 Katalysatoreinfluss auf eine chemische Reaktion
Katalysatoreinfluss auf eine chemische Reaktion
 Katalyse
Katalyse
 Enzymkinetik
Enzymkinetik









