Enzymreaktionen bei Stoffwechselprozessen
Enzyme sind Wirkstoffe, die biochemische Reaktionen im Körper beeinflussen und steuern. Zu diesen biochemischen Reaktionen zählen lebenswichtige Prozesse, wie die Verdauung, die Regelung des Blutzuckerspiegels oder die Pubertät.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Was sind Enzyme?
Enzyme sind Biokatalysatoren. Jede biochemische Reaktion ist an ein bestimmtes Enzym gekoppelt. Auf diese Weise können Reaktionen in Lebewesen beschleunigt und reguliert werden. Von besonderer Bedeutung unter diesen biochemischen Reaktionen sind die Stoffwechselreaktionen, wie die Verarbeitung von Eiweißen, Fetten und Kohlenhydraten aus der Nahrung. Ohne Enzyme könnten solche Reaktionen entweder gar nicht oder nur vollkommen unkontrolliert ablaufen. Auch Anwendungen von Enzymen in Medizin und Technik sind von großer Bedeutung. Ärztinnen und Ärzte können beispielsweise die Enzymaktivitäten im Blut untersuchen, um unter anderem Störungen des Fettstoffwechsels, des Blutzuckerspiegels oder sogar der Immunabwehr festzustellen.
Wirkungsweise von Enzymen
Um die Funktionsweise von Enzymen in der Biologie zu verstehen, muss man zunächst wissen, wie der Bau eines Enzyms aussieht. Enzyme sind große organische Moleküle und gehören alle zu den Proteinen.

Jedes Enzym besitzt ein aktives Zentrum. Das sind extra auf den Reaktionspartner, auch Substrat genannt, angepasste Andockplätze. Jedes Enzym ist auf genau ein Substrat spezialisiert. Das Prinzip des Erkennens eines bestimmten Substrates nennt man daher auch Schlüssel-Schloss-Prinzip. Ist das bestimmte Substrat in der Nähe, bindet es an das aktive Zentrum des Enzyms, sodass sie gemeinsam einen Enzym-Substrat-Komplex bilden. Nach der Induced-Fit-Theorie passen sich sowohl Enzym als auch Substrat nochmals aneinander an. In dieser Konformation nimmt nun das Enzym Einfluss auf die Reaktion, indem es die nötige Aktivierungsenergie für die Reaktion herabsetzt. Enzyme sind also nicht nur substratspezifisch, sondern auch wirkungsspezifisch, da sie nur eine bestimmte Reaktion katalysieren.
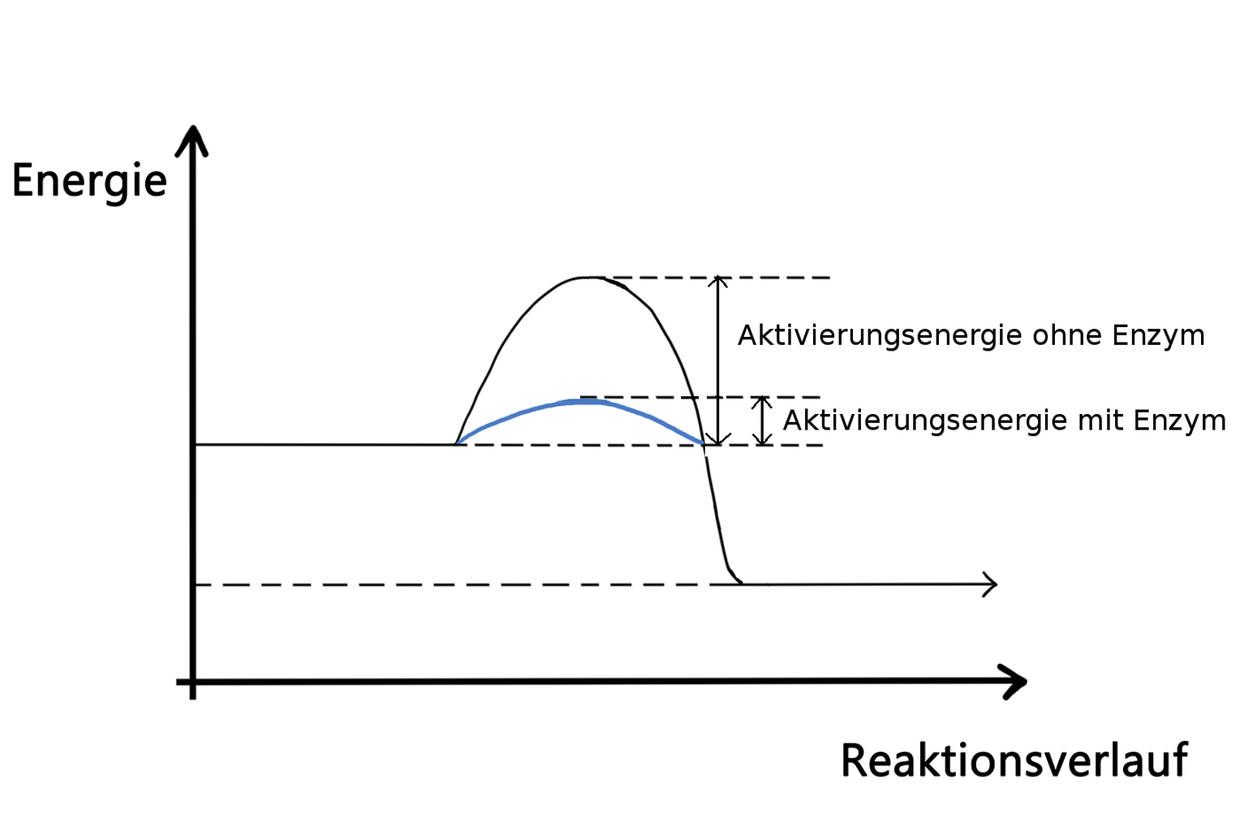
Für die Enzymregulation besitzen Organismen bestimmte Stoffe, die Enzyme hemmen können. Man unterscheidet zwischen zwei verschiedenen reversiblen Hemmungen. Bei der kompetitiven Hemmung wird ein Molekül ausgeschüttet, das dem Substrat sehr ähnlich ist. Dadurch kann es an das aktive Zentrum binden, aber anschließend nicht reagieren. Auf diese Weise blockiert es das Enzym für das eigentliche Substrat und die Reaktion kommt zum Erliegen. Bei der allosterischen Hemmung werden Stoffe ausgeschüttet, die sich an einem zweiten, eigens für diesen Zweck geschaffenen, aktiven Zentrum binden können. Wird es besetzt, ändert sich die Konformation des eigentlichen aktiven Zentrums und das Substrat kann nicht mehr an ihm binden.
Einflüsse auf Enzymaktivität
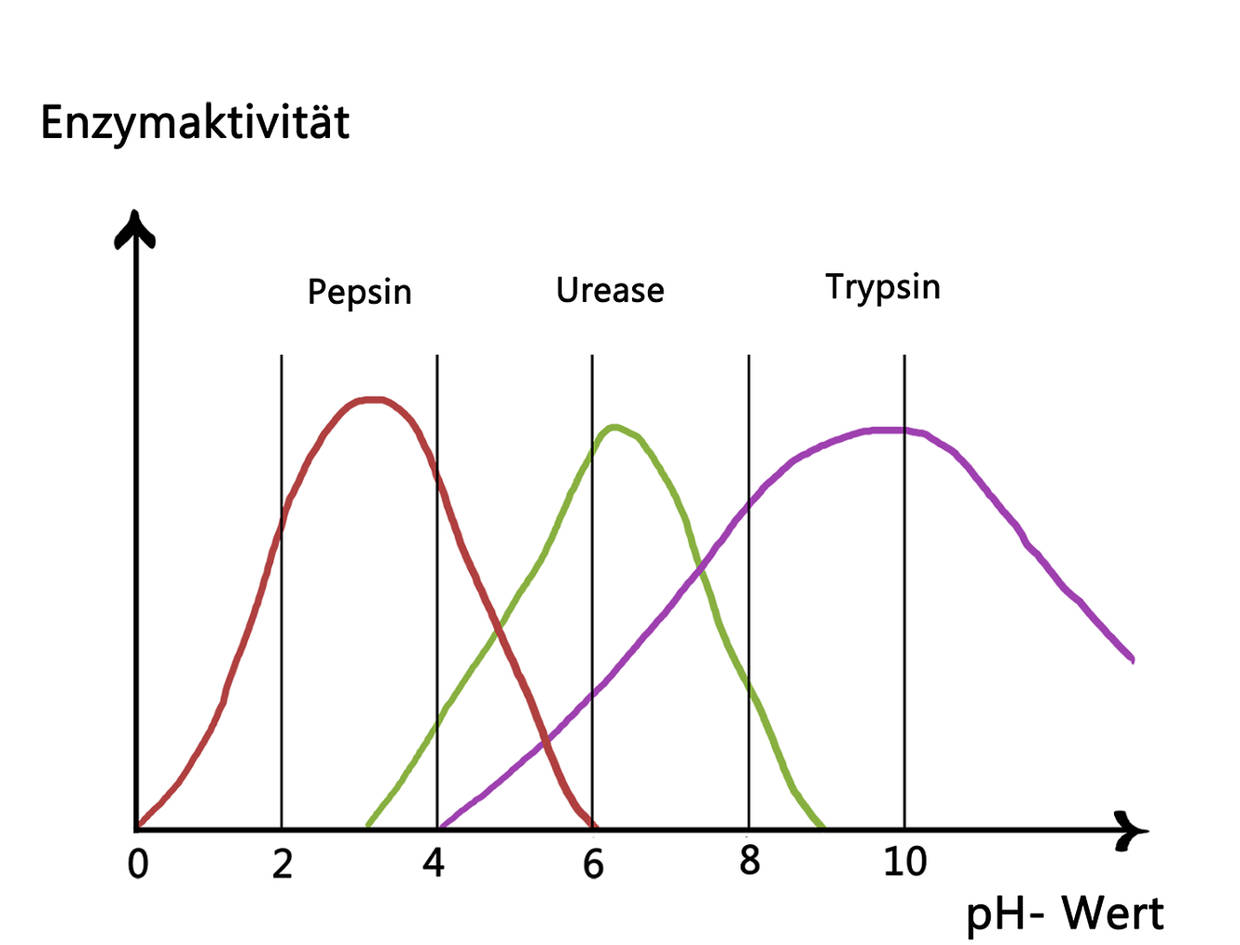
Äußere Faktoren, wie die Temperatur und der pH-Wert, haben einen Einfluss auf die Enzymaktivität. Der pH-Wert ist ein Maß dafür, wie sauer oder basisch eine Lösung ist. Der pH-Wert im Blut beträgt zum Beispiel ca. 7,4. Dieser Wert ist neutral und alle im Blut aktiven Enzyme sind auf ihn angepasst und arbeiten bei diesem pH-Wert am effektivsten. Bei kleinen Abweichungen sinkt die Aktivität der Enzyme. Werden die Abweichungen zu groß, denaturieren sie sogar. Das bedeutet, dass sie ihre strukturelle Form und ihre Funktion verlieren. In manchen Körperregionen herrschen andere pH-Werte. Die Magensäure zum Beispiel ist mit einem pH-Wert von 1–4 sehr sauer. Das Enzym Pepsin, welches Proteine der Nahrung im Magen verarbeitet, zeigt daher die höchste Aktivität in sehr sauren Umgebungen. Andere Enzyme würden im Magen denaturieren.
An die Temperaturempfindlichkeit von Enzymen haben sich die gleichwarmen Tiere auf besondere Art angepasst. Alle chemischen Reaktionen laufen schneller ab, je wärmer es ist. Das liegt daran, dass Wärme eine Form von Energie ist und Energie für viele Reaktionen benötigt wird. Man geht grob von der RGT-Regel (Reaktionsgeschwindigkeit-Temperatur-Regel) aus. Sie besagt, dass eine Erhöhung der Temperatur um 10 °C zu einer Verdopplung bzw. Verdreifachung der Reaktionsgeschwindigkeit führt. Allerdings denaturieren Enzyme auch bei zu hohen Temperaturen. Eine konstante Körpertemperatur von 37 °C bietet also die optimalen Bedingungen für die Enzymaktivität und einen sehr effektiven Stoffwechsel. Gleichzeitig lässt diese Temperatur aber auch noch etwas Raum nach oben. Das Fieber ist zum Beispiel eine Reaktion unseres Immunsystems auf Krankheitserreger, das oft dazu führt, dass die Enzymaktivität der Krankheitserreger gestört wird. Gerade deshalb ist zu hohes Fieber aber auch so gefährlich.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Enzymreaktionen bei Stoffwechselprozessen (3 Videos, 3 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Enzymreaktionen bei Stoffwechselprozessen (3 Arbeitsblätter)
Beliebteste Themen in Biologie
- Was ist DNA
- Organe Mensch
- Meiose
- Pflanzenzelle
- Blüte Aufbau
- Feldmaus
- Chloroplasten
- Chlorophyll
- Rna
- Chromosomen
- Rudimentäre Organe
- Wirbeltiere Merkmale
- Mitose
- Seehund
- Modifikation
- Bäume Bestimmen
- Metamorphose
- Synapse
- Synapse Aufbau und Funktion
- Ökosystem
- Amöbe
- Blobfisch
- Phänotyp
- Endoplasmatisches Retikulum
- Karyogramm
- RGT Regel
- Biotop
- Eukaryoten
- Zellmembran
- Calvin-Zyklus
- Codesonne
- Fotosynthese
- Allel
- Ribosomen
- Golgi-Apparat
- Nukleotid
- Mitochondrien
- Genotyp
- Zellorganellen
- Phospholipide
- Vakuole
- Gliazellen
- Nahrungskette Und Nahrungsnetz
- Phagozytose
- Vesikel
- Biozönose
- tRNA
- Kompartimentierung
- Sympatrische Artbildung
- Transpiration









 Enzyme – Bau und Wirkungsweise
Enzyme – Bau und Wirkungsweise
 Enzyme – Funktionsweise (Basiswissen)
Enzyme – Funktionsweise (Basiswissen)
 Enzyme – Anwendung in Medizin und Technik
Enzyme – Anwendung in Medizin und Technik









