Aufbau des Atomkerns
Nuklide, Isotope und ihre Bausteine Proton und Neutron sowie der Massendefekt und Bindungsenergie
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Einleitung - die Entdeckung des Atomkerns
- Der Aufbau des Atomkerns
- Einteilung und Beschreibung der Nuklide
- Kernkräfte und Massendefekt
Einleitung - die Entdeckung des Atomkerns
Der Physiker Ernest Rutherford führte im Jahre 1909 seinen bekannten Streuversuch durch. Er wollte damit eigentlich das Thomson'sche Atommodell bestätigen. Dieses damals verbreitete Atommodell versteht das Atom als eine kleine positiv geladene Masse, in der die negativ geladenen Elektronen wie Rosinen in einem Kuchen sitzen. Durch sein Experiment gelangte Rutherford aber zu der Erkenntnis, dass das Atom einen positiven geladenen Kern haben muss, der nahezu die gesamte Masse des Atoms in sich vereinigt. Die Elektronen hingegen bewegen sich frei um den Kern in der Elektronen- oder auch Atomhülle. Dieses neue Atommodell trägt den Namen seines Entdeckers nämlich Rutherford'sches Atommodell.
Der Aufbau des Atomkerns
Da ein Atomkern so klein ist, dass er auch mit modernster Technik nicht sichtbar gemacht werden kann, ist die Wissenschaft stets bemüht, Modelle zu entwickeln, die die wahre Natur des Kerns bestmöglich beschreiben. Heute geht man davon aus, dass sich der Atomkern aus positiv geladenen Protonen und elektrisch neutralen Neutronen zusammensetzt. Diese werden, als Bausteine des Kerns ( lat. „nucleus“), oder auch als Nukleonen bezeichnet. Der Atomkern als Ganzes wird Nuklid genannt.
Charakteristische Zahlen eines Atomkerns
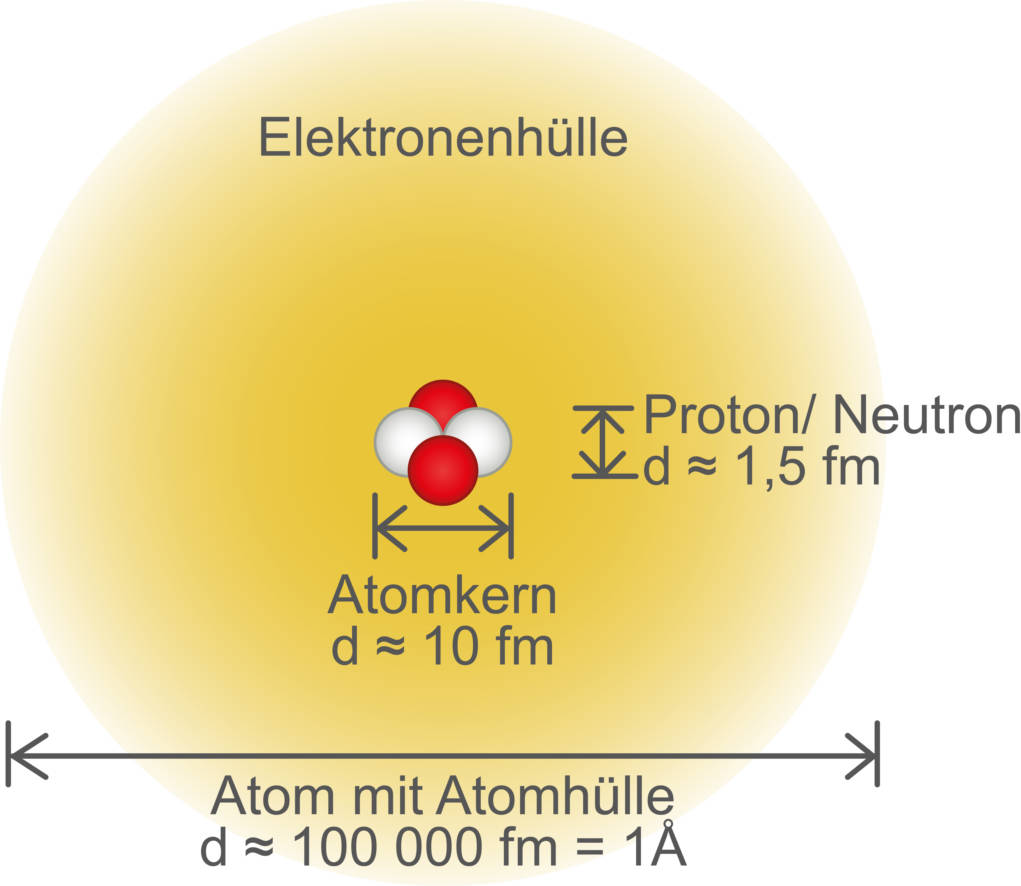
Protonen und Neutronen haben eine vergleichbare Masse. So ist die Masse des Protons $m_p=1,673\cdot10^{-27}\,$kg und die des Neutrons $m_n=1,675\cdot10^{-27}\,$kg. Zusammen vereinigen sie nahezu die gesamte Masse eines Atoms in sich. Zum Vergleich: Die Elektronen in der Atomhülle sind etwa 2.000 mal leichter und tragen daher nicht viel zum Gesamtmasse eines Atoms bei.
Die Größenverhältnisse im Atom sind umgekehrt. Obwohl der Atomkern so schwer ist, ist er im Vergleich zur Größe des Atoms verschwindend klein. Ein Atom hat in etwa einen Durchmesser von einem Ångström (Å), das sind $0,1\,$Nanometer (nm) oder $10^{-10}\,$Meter (m). Der Atomkern hingegen ist nochmal in etwa 100.000 mal kleiner ($10^{-15}\,$m). Zur Anschaulichkeit kannst du dir die Größenverhältnisse auch wie eine Erbse inmitten eines Fußballstadion vorstellen. Die Erbse entspricht dabei dem Atomkern und das Stadion der Elektronenhülle. Ein Atom besteht demnach größtenteils aus quasi „Nichts“.
Einteilung und Beschreibung der Nuklide
Kennst du das Modell des Atomkerns? Wie du nun weißt, ist ein Nuklid ein Atomkern, bestehend aus einer gewissen Anzahl von Protonen und Neutronen. Damit die genaue Anzahl der Bausteine eindeutig ist, werden die Nuklide durch zwei Kennzahlen beschrieben.
Die Kernladungszahl $Z$ gibt die Anzahl der positiven Ladungen im Kern an. Diese Zahl ist gleichbedeutend mit der Anzahl der Protonen im Kern. Da die Protonenzahl entscheidend für die chemischen Eigenschaften eines Atoms ist, werden die chemischen Elemente im Periodensystem aufsteigend nach ihrer Protonenzahl geordnet. Die Kernladungszahl wird daher auch Ordnungszahl genannt. Alle Nuklide mit der gleichen Kernladungszahl gehören zum selben chemischen Element, unabhängig von ihrer Massenzahl.
Die Massenzahl $A$ gibt die Masse eines Nuklids an. Da Protonen und Neutronen fast gleich schwer sind, ist die Massenzahl die Summe aus Kernladungszahl und Neutronenzahl $N$.
$A=Z+N$
Isotope und Nuklidschreibweise
Es gibt Kerne, die bei gleicher Kernladungszahl verschiedene Massenzahlen haben. Das heißt, solche zwei Nuklide unterscheiden sich in ihrer Neutronenzahl, nicht aber in der Anzahl der Protonen. Solche Nuklide nennt man Isotope.
Die zwei bekanntesten Isotope des Kohlenstoffs (C) sind C-12 mit sechs Protonen und Neutronen und C-14 mit ebenfalls sechs Protonen, aber acht Neutronen. Ein weiteres Beispiel ist Uran (U) mit seinen Isotopen U-235 und U-238. Aber auch Wasserstoff liegt mit keinem, einem oder zwei Neutronen im Kern vor.
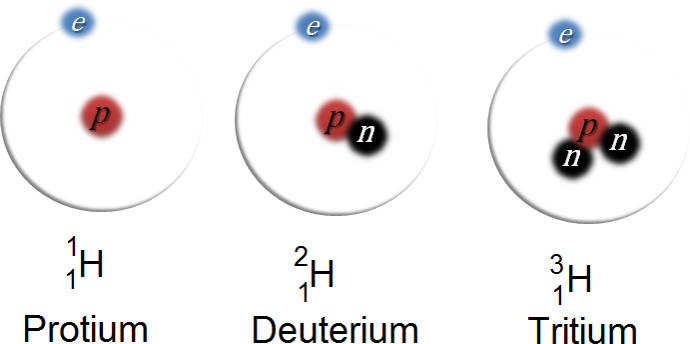
Als Schreibweise der Nuklide verwendet man konventionell das Elementsymbol mit tiefgestellter Kernladungszahl und hochgestellter Massenzahl. Kohlenstoff und Uran werden beispielsweise folgendermaßen dargestellt:
$ _{6}^{12}\text{C} \text{ , } _{6}^{14}\text{C} \text{ , } _{92}^{235}\text{U} \text{ , } _{92}^{238}\text{U}.$
Kernkräfte und Massendefekt
Vielleicht hast du dir inzwischen schon die Frage gestellt, warum ein Kern überhaupt zusammenhält? Schließlich hast du gelernt, dass die Protonen im Kern positiv geladen sind und positive Ladungen sollten sich eigentlich abstoßen. Dies ist im Prinzip auch richtig. Allerdings gibt es neben der Coulombkraft (elektromagnetische Wechselwirkung) noch drei weitere Grundkräfte der Physik: Die Gravitation, die schwache Wechselwirkung und die starke Wechselwirkung.
Die Gravitation kannst du vernachlässigen, da sie von der Masse abhängt und die Masse der Nukleonen sehr klein ist. Die schwache Wechselwirkung spielt nur bei $\beta$-Zerfällen von Atomkernen (Radioaktivität) eine Rolle. Die starke Wechselwirkung hingegen heißt so, weil sie die stärkste von allen ist. Sie ist also insbesondere auch stärker als die abstoßend wirkende Coulombkraft. Die starke Wechselwirkung wirkt zwischen allen Nukleonen gleichermaßen anziehend und sorgt dafür, dass der Kern stabil ist. Daher wird sie auch Kernkraft genannt. Die Bindungsenergie liegt bei schwereren Kernen in etwa bei $8\,$MeV pro Nukleon.
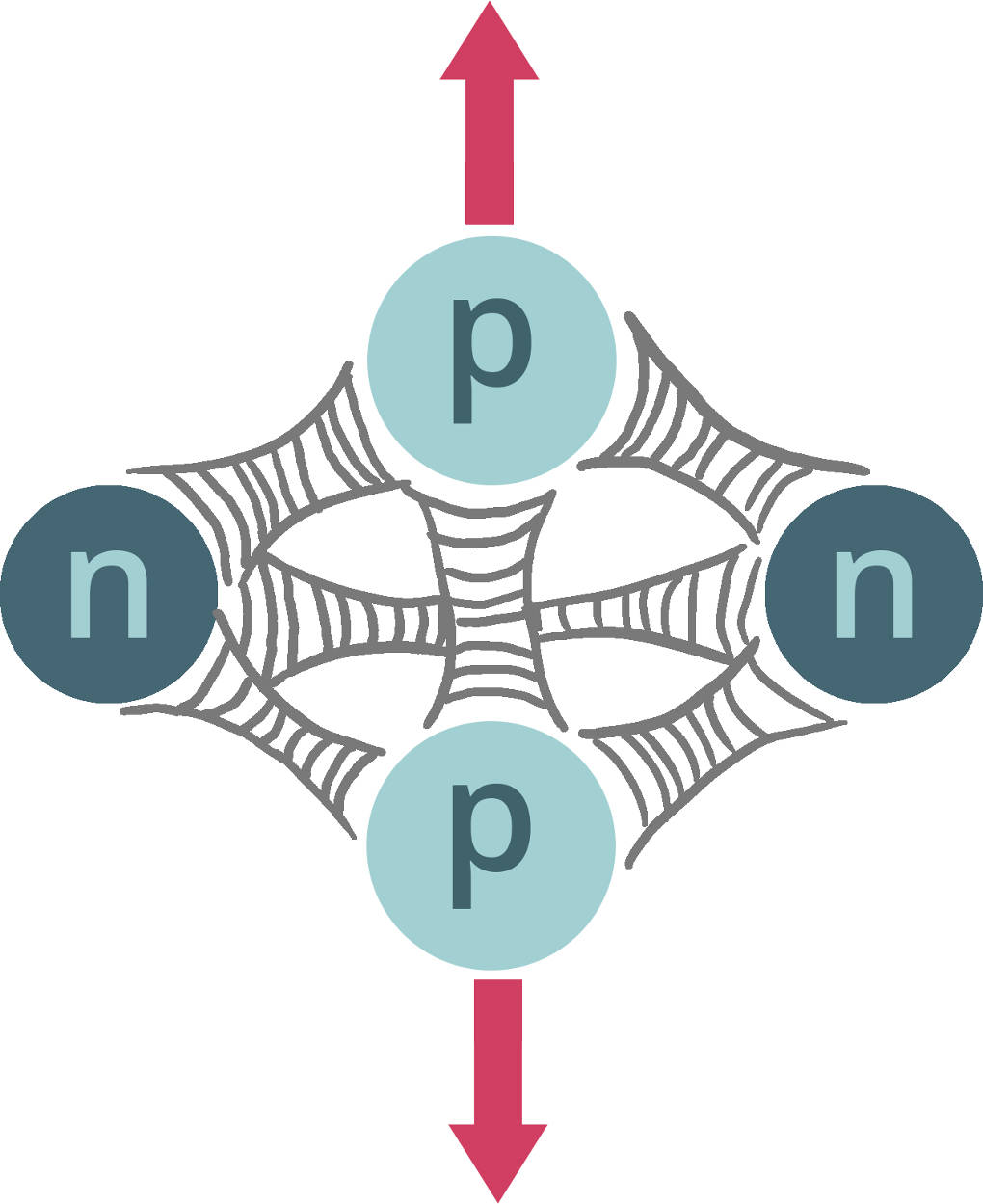
Diese Kraft hat allerdings nur eine sehr kleine Reichweite und wirkt daher nur, wenn Protonen und Neutronen ganz nah beieinander sind (wie in einem Kern). Sobald sich die Protonen etwas voneinander entfernen würden, verliert die Kernkraft ihre Wirkung und die Protonen stoßen sich so ab (vgl. $\alpha$-Zerfall), wie du es gelernt hast.
Massendefekt
Die Bindungsenergie der Kernbausteine kann aufgrund der Energieerhaltung nicht einfach entstehen, sie muss irgendwo herkommen. Laut Einsteins bekannter Formel
$E=mc^2$
ist Energie äquivalent zu Masse. Die Bindungsenergie könnte also aus der Masse der Protonen und Neutronen stammen. Tatsächlich ist die Masse eines Kerns immer kleiner als die Summer der Massen der Protonen und Neutronen, aus dem er besteht. Dieses Phänomen ist als Massendefekt bekannt. Anschaulich gesprochen wandeln Protonen und Neutronen also einen Teil ihrer Masse in Bindungsenergie um, die sie als Kern zusammenhält.
Alle Videos zum Thema
Videos zum Thema
Aufbau des Atomkerns (4 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Aufbau des Atomkerns (3 Arbeitsblätter)
Beliebteste Themen in Physik
- Temperatur
- Schallgeschwindigkeit
- Dichte
- Transistor
- Lichtgeschwindigkeit
- Galileo Galilei
- Rollen- Und Flaschenzüge Physik
- Radioaktivität
- Lorentzkraft
- Beschleunigung
- Gravitation
- Hookesches Gesetz Und Federkraft
- Elektrische Stromstärke
- Elektrischer Strom Wirkung
- Reihenschaltung
- Ohm'Sches Gesetz
- Freier Fall
- Kernkraftwerk
- Atom
- Aggregatzustände
- Infrarot, Uv-Strahlung, Infrarot Uv Unterschied
- Isotope, Nuklide, Kernkräfte
- Transformator
- Lichtjahr
- Si-Einheiten
- Fata Morgana
- Gammastrahlung, Alphastrahlung, Betastrahlung
- Kohärenz Physik
- Mechanische Arbeit
- Schall
- Elektrische Leistung
- Dichte Luft
- Ottomotor Aufbau
- Kernfusion
- Trägheitsmoment
- Heliozentrisches Weltbild
- Energieerhaltungssatz Fadenpendel
- Linsen Physik
- Ortsfaktor
- Interferenz
- Diode
- Wärmeströmung (Konvektion)
- Schwarzes Loch
- Frequenz Wellenlänge
- Elektrische Energie
- Parallelschaltung
- Dopplereffekt, Akustischer Dopplereffekt
- Kernspaltung
- Reibungskraft
- Fliehkraft







 Die Entdeckung des Atomkerns
Die Entdeckung des Atomkerns
 Die vier Grundkräfte
Die vier Grundkräfte
 Kernbausteine - Massendefekt - Bindungsenergie
Kernbausteine - Massendefekt - Bindungsenergie









