Moleküldarstellungen in Lewis-Formeln
Lewis-Formeln sind Valenzstrichformeln. Die Formeln stellen alle Valenzelektronen als bindende und freie Elektronenpaare dar.
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Entwicklung der Lewis-Formeln
Es war lange ein Rätsel, wie Verbindungen und vor allem chemische Bindungen zustande kommen. Somit ließen sich auch keine Aussagen über die Strukturformeln von Molekülen treffen, wie wir es heute mit den Lewis-Formeln treffen können.
Um die Struktur zu verstehen, ist es wichtig zu wissen, dass Elemente einen energiearmen Zustand anstreben, vor allem die Edelgaskonfiguration. Edelgase besitzen acht Außenelektronen (außer Helium), auch Valenzelektronen genannt. Damit besitzen sie eine vollbesetzte Außenschale. Dieser Zustand ist besonders energiearm und damit sehr stabil. Dies bezeichnet die Oktettregel. Darum gehen sie Bindungen ein und bilden Ionen.
Gilbert Newton Lewis kam 1916 auf die Idee, dass Bindungen durch Elektronenpaare gebildet werden. Jeder der Bindungspartner stellt dabei ein Elektron zur Verfügung. In der Verbindung teilen sich die Partner nun beide Elektronen. Er ist somit der Namensgeber für die Lewis-Formeln.

Am Beispiel von Wasserstoff wird es deutlich. Ein Wasserstoffatom besitzt ein Außenelektron. Die nächste Edelgaskonfiguration besitzt Helium mit zwei Außenelektronen. Geht das Wasserstoffatom nun eine Bindung ein, z.B. mit einem anderen Wasserstoffatom, besitzt es zwei Außenelektronen. Nun besitzt es die Edelgaskonfiguration von Helium und ist stabil.
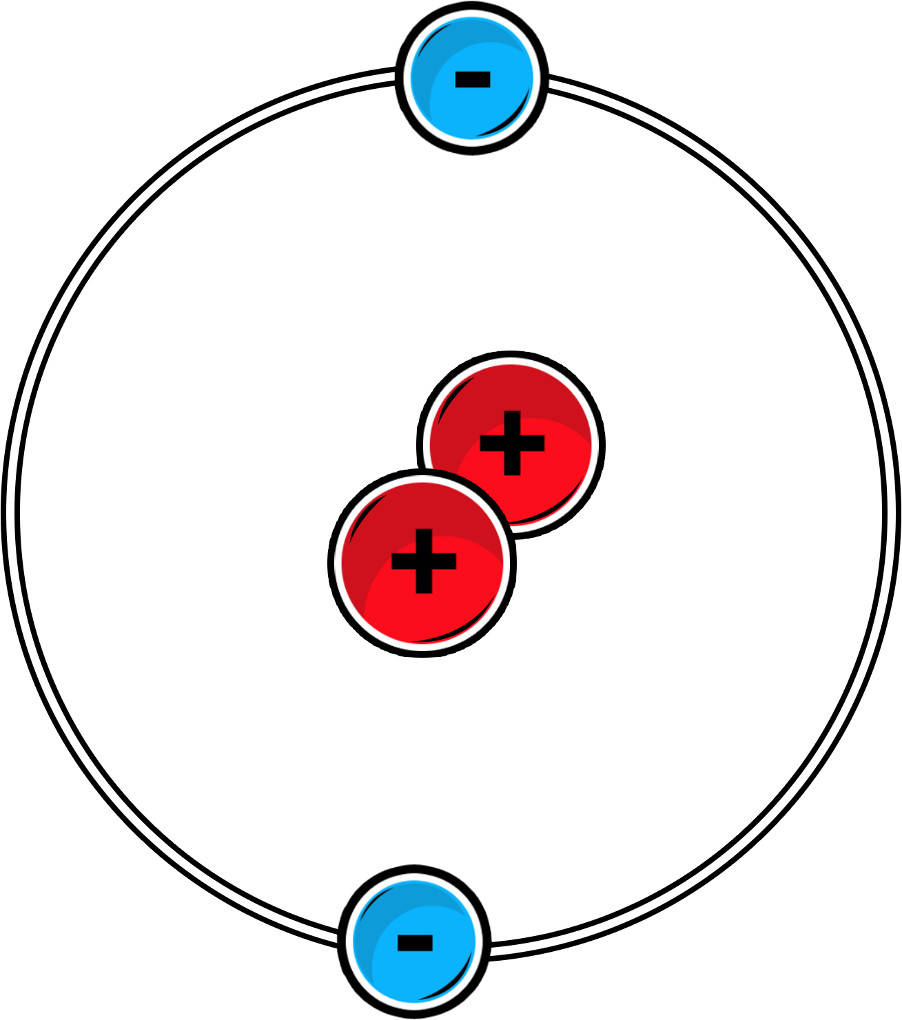
Aufstellen von Valenzstrichformeln
Eine Valenzstrichformel zeigt alle Außenelektronen einer Verbindung. Dabei werden immer zwei Elektronen zu einem Paar zusammengefasst. Die eigentliche Lewis-Formel zeigt die Elektronen allerdings als Punkte und nicht als Striche. In Lewis-Formeln können Elektronen also differenzierter dargestellt werden, was in manchen Fällen von Vorteil ist. Der Vorteil beider Schreibweisen ist allerdings, dass Moleküle genauer dargestellt werden können als mittels Summenformel. So kann ein Eindruck für die räumliche Anordnung der Atome entstehen.
Um eine Valenzstrichformel einer Verbindung aufstellen zu können, muss man als erstes wissen, welche Elemente in der Verbindung enthalten sind. Als Beispiel schauen wir uns die Struktur des Sauerstoffs in der Lewis-Formel. Nun ist es wichtig zu wissen, wie viele Valenzelektronen Sauerstoff besitzt.
Sauerstoff befindet sich in der 6. Hauptgruppe des Periodensystems. Es hat demzufolge sechs Außenelektronen. Um die Elektronenkonfiguration des nächsten Edelgases (Neon) zu erreichen, benötigt es noch zwei weitere Elektronen. Sauerstoff muss also zwei Bindungen eingehen, um einen stabilen Zustand zu erreichen.
Mit einem weiteren Sauerstoffatom geht unser Sauerstoff nun zwei Bindungen ein. Zwei Elektronen des Sauerstoffs stecken in den Bindungen. Es bleiben daher noch vier Elektronen übrig, also zwei Elektronenpaare. Diese nennt man freie Elektronenpaare. Beim Sauerstoffmolekül $O_2$, besitzen also beide Sauerstoffatome jeweils zwei freie Elektronenpaare. Beide haben nun acht Außenelektronen und sind damit stabil. Als Valenzstrichformel sieht das Sauerstoffmolekül folgendermaßen aus.
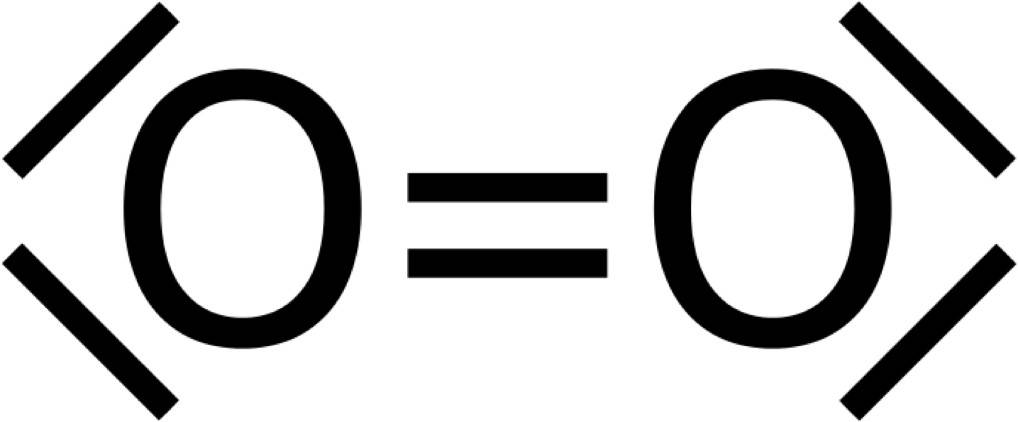
Grenzstrukturen der Lewis-Formeln
Wenn für Moleküle Lewis-Formeln aufgestellt werden, kann es zu sogenannten Grenzstrukturen kommen. Das bedeutet, dass es nicht nur eine Anordnung der Elektronenpaare gibt, sondern mehrere. Dabei spielen die $\Pi$-Elektronen von Doppelbindungen eine wichtige Rolle. Wenn eine Lewis-Formel mehrere Grenzstrukturen aufweist, spricht man von Mesomerie.
Als erstes Beispiel wird Ozon beleuchtet. Ozon besteht aus drei Sauerstoffatomen und besitzt die Summenformel $O_3$. Hier siehst du eine Valenzstrichformel von Ozon.
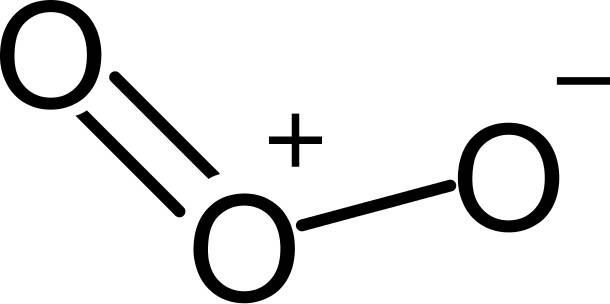
Du siehst in der Strukturformel, dass eine postive Ladung in der Mitte und eine negative Ladung auf der linken Seite ist. Diese negative Ladung kann aber genauso gut auf der rechten Seite liegen. Das geschieht durch ein Umklappen der Doppelbindungen.
Das Paradebeispiel für Mesomerie und damit Grenzstrukturen ist Benzol.
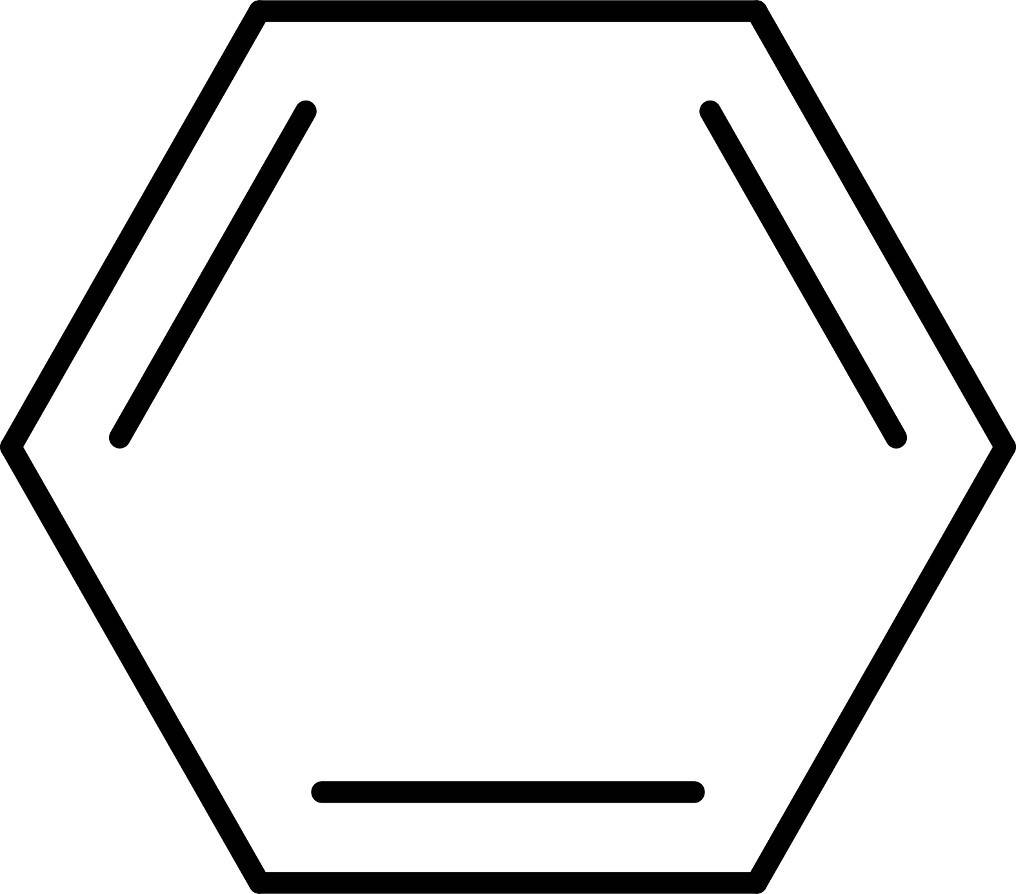
Hier kannst du dir leicht vorstellen wie alle drei Doppelbindungen wegklappen können. Aus diesem Grund kann man für dieses Molekül zwei Strukturformeln aufstellen. Da beide Formen der Lewis-Formel gleich wahrscheinlich sind, schreibt man für die sechs Elektronen im Ring oft einen Kreis anstelle der drei Bindungen.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Moleküldarstellungen in Lewis-Formeln (8 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Moleküldarstellungen in Lewis-Formeln (4 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff














 Lewis-Formeln – Darstellung chemischer Verbindungen
Lewis-Formeln – Darstellung chemischer Verbindungen
 Aufstellen von Valenzstrichformeln
Aufstellen von Valenzstrichformeln
 Formalladungen in Lewis-Formeln
Formalladungen in Lewis-Formeln
 Lewis-Formel – Valenzstrich
Lewis-Formel – Valenzstrich









