Essigsäure und weitere Carbonsäuren
Essigsäure ist eine Carbonsäure, sie besitzt die Carboxyl-Gruppe als funktionelle Gruppe. Die Struktur und Nomenklatur der Alkansäuren ist analog zu denen der Alkane.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Carbonsäuren im Alltag
In unserem Alltag finden sich viele natürliche Säuren. Man findet sie in sauren aber auch in süßen Früchten als Fruchtsäuren, aber auch in Milch und allen Milchprodukten als Milchsäure. Daher kann Milch auch sauer werden.

Alle diese Säuren haben gemeinsam, dass sie eine oder mehrere Carboxyl-Gruppen ($R-COOH$) als funktionelle Gruppe aufweisen. Säuren mit dieser funktionelle Gruppe nennt man Carbonsäuren. Eine sehr wichtige Vertreterin dieser Gruppe, die wir häufig nutzen, ist Essigsäure. Diese Säure kennst du vielleicht eher in verdünnter Form als Essig.
Essigsäure
Essigsäure ist eine klare farblose Flüssigkeit. Reine Essigsäure wird bereits bei unter $16,64^\circ C$ fest und bildet den sogenannten Eisessig. Es handelt sich bei der Essigsäure um eine kurzkettige Carbonsäure. Sie besitzt die Konstitutionsformel $CH_3COOH$. Doch warum ist Essig sauer? Die enthaltene Carboxyl-Gruppe verleiht der Verbindung ihren sauren Charakter. Nach IUPAC wird sie als Ethansäure bezeichnet.
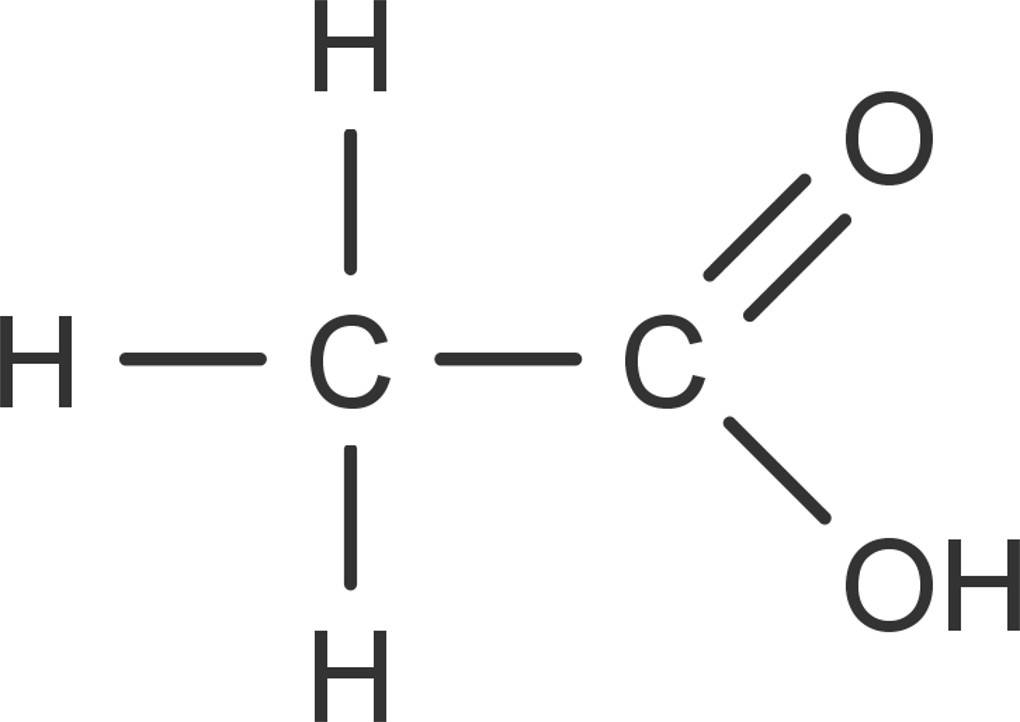
Reine Essigsäure ist brennbar und besitzt einen stechenden Geruch. Durch die polare Carboxyl-Gruppe ist sie unbegrenzt mit Wasser mischbar. Sie wirkt in konzentrierter Form stark ätzend. In verdünnter Form kann aber auf Schutzhandschuhe verzichtet werden. Essigsäure gehört zu den schwachen Säuren. Sie protolysiert also nicht vollständig. Unedle Metalle und einige Carbonate werden von dieser Säure gelöst. Es entstehen Salze der Essigsäure, die Acetate.
Essigsäure entsteht bei Gärungs- und Abbauprozessen. Wenn Wein lange offen steht, kann man einen säuerlichen Geruch wahrnehmen. Dieser stammt vom gebildeten Essig, der durch die Umwandlung von Ethanol durch Essigbakterien entsteht. Dieser Vorgang wird gezielt genutzt, um wertvollen Wein- und Fruchtessig zu gewinnen. Auch bei Stoffwechselvorgängen entsteht Essigsäure.
Essig wird in verdünnter Form als Speiseessig benutzt. Essigessenz enthält ca. 25% Essigsäure und ist zum Putzen und Entfernen von Kalk geeignet. Acetate werden mitunter von der Textil- und Lederindustrie als Hilfsstoffe in der Herstellung eingesetzt. Essigsäure dient auch als Konservierungsstoff aufgrund seiner keimtötenden Wirkung.
Fruchtsäuren
Die Fruchtsäuren besitzen neben der Carboxyl-Gruppe zusätzlich noch eine Hydroxyl- ($R-OH$) oder eine weitere Carboxyl-Gruppe. Fruchtsäuren kommen, wie der Name schon sagt, vor allem in Früchten vor. Aber auch in anderen Teilen von Pflanzen und sogar in Bier und Wein sind sie enthalten. Beispiele für solche Fruchtsäuren sind die Milchsäure, die Äpfelsäure, die Oxalsäure und die Weinsäure.
Verwendet werden diese Säuren oft als Putzmittel und als Zusätze für Nahrungsmittel. Auch in Kosmetika und Medikamenten finden sie Anwendung.
Alkansäuren
Alkansäuren sind abgeleitet aus den Alkanen. Die Bezeichnung erfolgt daher mit dem Wortstamm des Alkans und dem Wort Säure am Ende. Die Alkane sind eine homologe Reihe, die sich um das feststehende Glied $CH_2$ unterscheiden. Die Anzahl der enthaltenen C-Atome wird durch das Zahlwort am Anfang des Namens gekennzeichnet.
Alle Alkansäuren besitzen die Carboxyl-Gruppe. Es gibt kurzkettige Vertreter wie die Essigsäure und die Propansäure. Diese sind polar und damit wasserlöslich. Je länger die Alkankette der Säure wird, desto mehr nimmt der unpolare Charakter der Verbindung zu. Die Stearinsäure besitzt 17 C-Atome. Sie ist sehr unpolar und daher gut in Benzin und Ölen löslich. Sie gehört zu den sogenannten Fettsäuren, da sie mitunter Bestandteil von Fetten und Ölen ist.
Alle Videos zum Thema
Videos zum Thema
Essigsäure und weitere Carbonsäuren (19 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Essigsäure und weitere Carbonsäuren (12 Arbeitsblätter)
-
 Warum ist Essig sauer?
PDF anzeigen
Warum ist Essig sauer?
PDF anzeigen -
 Eigenschaften von Carbonsäuren
PDF anzeigen
Eigenschaften von Carbonsäuren
PDF anzeigen -
 Carbonsäuren – Nomenklatur und Struktur
PDF anzeigen
Carbonsäuren – Nomenklatur und Struktur
PDF anzeigen -
 Carbonsäuren mit zusätzlichen funktionellen Gruppen
PDF anzeigen
Carbonsäuren mit zusätzlichen funktionellen Gruppen
PDF anzeigen -
 Fruchtsäuren (Basiswissen)
PDF anzeigen
Fruchtsäuren (Basiswissen)
PDF anzeigen -
 Fruchtsäuren (Expertenwissen)
PDF anzeigen
Fruchtsäuren (Expertenwissen)
PDF anzeigen -
 Carbonsäureanhydride
PDF anzeigen
Carbonsäureanhydride
PDF anzeigen -
 Carbonsäureamide
PDF anzeigen
Carbonsäureamide
PDF anzeigen -
 Kohlensäure und Harnstoff
PDF anzeigen
Kohlensäure und Harnstoff
PDF anzeigen -
 Carbonsäurederivate
PDF anzeigen
Carbonsäurederivate
PDF anzeigen -
 Decarboxylierung
PDF anzeigen
Decarboxylierung
PDF anzeigen -
 Veresterung und Acylierung
PDF anzeigen
Veresterung und Acylierung
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff

































