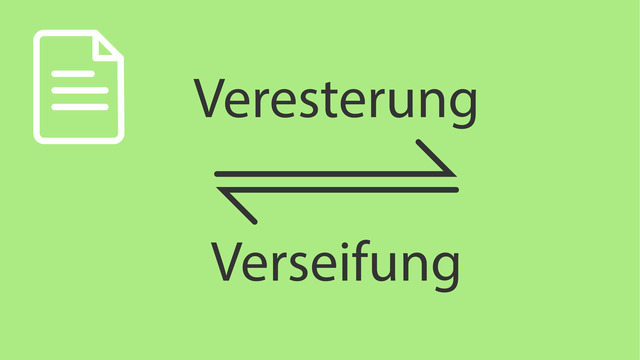
Veresterung

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Veresterung
In diesem Video geht es um den Reaktionsmechanismus der Veresterung. Zunächst wird euch an Beispielen die Bedeutung von Estern im Alltag gezeigt. Danach lernt ihr, welche Probleme es bei der Synthese gibt. Ihr lernt detailliert den Reaktionsmechanismus kennen und beide möglichen Synthesevarianten. Ihr lernt, welche wasserentziehenden Mittel man für eine bessere Ausbeute nutzen kann und was man unter einer azeotropen Veresterung versteht. Zum Abschluss gibt es eine kurze Zusammenfassung.
Transkript Veresterung
Guten Tag und herzlich willkommen. Dieses Video heißt Veresterung. Der Film gehört zur Reihe Reaktionsmechanismen. An Vorkenntnissen solltest du die organische Chemie bereits gut kennen. Die Lewis-Schreibweise ist dir vertraut. Mein Ziel ist es, dir den Zusammenhang zwischen Reaktionsmechanismus und Synthesedurchführung bei einer chemischen Reaktion klar zumachen. Der Film besteht aus 7 Abschnitten. 1. Bedeutung der Ester 2. Syntheseprobleme 3. Der Mechanismus 4. 2 Synthesevarianten 5. Wasserentziehende Mittel 6. Azeotrope Veresterung und 7. Zusammenfassung
Bedeutung der Ester. Ester sind als Fruchtester in vielen Früchten vertreten. Als schöne Bekleidung finden wir viele Polyester. Und schließlich: Was wäre die Getränkeindustrie ohne die PET-Flaschen? PET ist auch ein Polyester.
Syntheseprobleme. Das Reaktionsschema der Veresterung lautet Carbonsäure + Alkohol stehen im chemischen Gleichgewicht zu Ester und Wasser. Unter Nutzung der funktionellen Gruppen kann man die Reaktion auch so formulieren. Die Reaktionsgeschwindigkeit der Veresterung ist sehr klein. Durch einen sauren Katalysator kann man die Reaktionsgeschwindigkeit erhöhen. Durch das Gleichgewicht ist der Umsatz X<100%. Der Umsatz lässt sich steigern, wenn man die Menge eines der Edukte erhöht. Man verwendet von ihm einen Überschuss. Man kann auch ein Produkt, meist ist das Wasser, abführen und kommt zum gleichen Ergebnis. Durch beide Maßnahmen wird der Umsatz gesteigert und damit Y, die Ausbeute, erhöht.
Der Mechanismus. Ich schreibe nur mit Formeln, daher seid bitte so nett und hört aufmerksam zu. Im ersten Schritt reagiert das Carbonsäure-Molekül mit einem Wasserstoff-Ion, einem Proton. Es entstammt der Säure (HA). Es entsteht ein Kation mit Ladung am Kohlenstoff-Atom. Das Wasserstoff-Ion verbindet sich mit einem Elektronenpaar der Carboxygruppe des Carbonsäuremoleküls. Das Alkoholmolekül hat freie Elektronenpaare, ist nukleophil, kernsuchend. Es greift nun das Kation an. Es entsteht ein neues Kation mit der positiven Ladung am Sauerstoff-Atom. Von dieser Position löst sich das Wasserstoff-Ion ab und wandert zu einem freien Elektronenpaar, einer Hydroxygruppe. Dadurch wechselt die positive Ladung auch ihren Aufenthaltsort. Nun wird ein Wassermolekül abgespalten. Dabei wird ein Bindungselektronenpaar zu einem freien Elektronenpaar. Es entsteht ein Kation mit Ladung am Kohlenstoffatom. Aus dem freien Elektronenpaar des Sauerstoffatoms wird eine Bindung vom Sauerstoffatom mit dem Kohlenstoffatom. Die Ladung befindet sich nun am Sauerstoffatom. Im letzten Schritt bildet sich das Estermolekül. Dabei wird das Bindungselektronenpaar zum Sauerstoffatom verschoben. Im Ergebnis wird das Proton abgespalten und kehrt zum Anion, der Säure, zurück. Das gebildete Estermolekül lässt sich umschreiben und wir erkennen dann auch die funktionelle Estergruppe, oben links, wieder. Um das alles zu verstehen, müsst ihr nicht nur hören, sondern auch üben, das alles einmal selber aufschreiben.
2 Synthesevarianten. In der Literatur findet man Ausbeuten zwischen 70 und 90%, im Durchschnitt um die 80% für die präparative Veresterung aus Carbonsäuren und Alkoholen. Ein Problem haben wir eingangs schon besprochen. Es bilden sich Ester und Wasser in einer Gleichgewichtsreaktion. Wenn man das Wasser aus dem Reaktionsgemisch entfernt, so wird das Gleichgewicht nach rechts verschoben und es bildet sich viel Ester. Es gibt verschiedene Möglichkeiten, das zu bewerkstelligen. Die beiden wichtigsten Möglichkeiten möchte ich aufzählen. Man kann a) Wasser entziehende Mittel wie konzentrierte Schwefelsäure oder Phosphorpentoxid einsetzen. Man kann auch b) zur azeotropen Veresterung greifen. Das bedeutet, dass man ein Lösungsmittel wie Toluol und Chloroform einsetzt, das zusammen mit Wasser ein sogenanntes Azeotrop bildet. Das ist ein homogener Stoff, der bei einer bestimmten Temperatur siedet. Man kann ihn destillativ aus dem Reaktionsgemisch abziehen.
Wasser entziehende Mittel. Die Carbonsäure soll mit dem Alkohol in gewohnter Weise reagieren. Wir setzen Schwefelsäure ein. In einer typischen Vorschrift findet man 1mol Carbonsäure. Der Alkohol muss absolut, das heißt wasserfrei, sein, denn wir wollen ja Wasser entziehen. Man setzt ihn im Überschuss ein, 5mol. Das ist sinnvoll, wenn der Alkohol im Vergleich zur Carbonsäure billig ist. Die Schwefelsäure wird in relativ großer Menge eingesetzt, 0,2mol. Sie ist konzentriert und wirkt sowohl als Katalysator als auch als Wasser entziehendes Mittel. Die Carbonsäure wird dann im Überschuss eingesetzt, wenn sie im Vergleich zum Alkohol billig ist. Bei entsprechender Aufarbeitung erzielt man gute bis sehr gute Ausbeuten.
Azeotrope Veresterung. Das Reaktionsschema lautet auch hier: Carbonsäure + Alkohol reagiert mit einem Katalysator und steht im chemischen Gleichgewicht zum Ester und zu Wasser. Nach der Vorschrift reagiert 1mol Carbonsäure mit 1,75mol Alkohol, der nicht absolut sein muss. Der Überschuss des Alkohols ist hier nicht so dramatisch. Der Katalysator erfüllt hier keine Trocknungsfunktion, allerdings muss er sauer sein. Man kann daher viel weniger einsetzen. An konzentrierter Schwefelsäure reichen 5g aus. Auch die gleichen Mengen an para-Toluolsulfonsäure oder an saurem Ionenaustauscher sind ausreichend. Als Lösungsmittel kann man Toluol oder Chloroform verwenden. Die Reaktion wird mit einem Wasserabscheider durchgeführt, wodurch das Wasser sukzessive aus dem Reaktionsgemisch entfernt wird. Der hier abgebildete Typ ist für Toluol geeignet, da dieses leichter als Wasser ist. Für Chloroform benötigt man eine andere Bauform. Auch bei dieser Methode erhält man im Regelfall Ausbeuten von 80% und mehr.
Zusammenfassung. Die Veresterung ist eine durch Säuren katalysierte Reaktion von Carbonsäuren mit Alkoholen. Der Mechanismus besteht aus mehreren Gleichgewichtsschritten. Um Umsatz und Ausbeute zu steigern, wird bei der Synthese das gebildete Wasser entfernt. Das geschieht mit einem Wasser entziehenden Mittel oder über ein Azeotrop mit einem Wasserabscheider.
Ich hoffe, ihr hattet ein wenig Freude und ich konnte euch helfen. Ich wünsche euch alles Gute und viel Erfolg, tschüss!
Veresterung Übung
-
Gib die wichtigsten Fakten zur Veresterung wieder.
TippsDas Proton der Säure nimmt an der Reaktion zwar teil, wird aber nicht verbraucht.
LösungEster sind in vielen Lebensmitteln enthalten, nicht nur in Früchten. Man findet sie zum Beispiel im Rotwein oder in pflanzlichen und tierischen Speicherfetten. Zu den natürlichen Produkten gehört auch das Bienenwachs, welches zu über 50% aus Estern besteht. Weiterhin sind alle Fette Ester. Sie bestehen aus Fettsäuren (Carbonsäuren) und einem Glycerinmolekül (dreiwertiger Alkohol).
Die künstlich hergestellten Fruchtester kommen in der Lebensmittelindustrie zur Anwendung. Sie können nach Apfel, Banane oder auch Erdbeeren riechen und du kannst sie zum Beispiel in Joghurt oder Süßigkeiten finden.
Carbonsäuren haben eine Carboxyl-Gruppe $(-COOH)$ und Alkohole eine Hydroxy-Gruppe $(-OH)$. Bei der Reaktion wird die sogenannte Estergruppe gebildet (siehe Bild). R1 stellt den Alkylrest der Carbonsäure dar und R2 den Alkylrest des Alkohols. Das Nebenprodukt Wasser bildet sich durch Abspaltung von $OH$ aus der Säure und von $H$ aus dem Alkohol. Das Wasser wird aus der Reaktion entfernt (zum Beispiel mittels Wasserabscheider), um eine höhere Ausbeute an Ester zu erzielen.
-
Erstelle den Reaktionsmechanismus der Veresterung.
TippsÜberlege dir, welche Ausgangsstoffe an der Veresterung beteiligt sind.
Die positive Ladung wandert während der Reaktion, wenn sich Atome/Atomgruppen an- oder umlagern.
LösungZuerst kommt der Katalysator zum Einsatz bzw. ein Proton des Katalysators. Es geht eine Bindung mit dem Sauerstoffatom der Carbonsäure ein, welches über eine Doppelbindung mit dem zentralen Kohlenstoffatom verbunden ist. Das entstandene Kation trägt die positive Ladung am zentralen Kohlenstoffatom. Als nächstes reagiert ein freies Elektronenpaar des Sauerstoffatoms des Alkohols mit dem Kation. Es bildet sich ein neues Kation mit der positiven Ladung an dem Sauerstoffatom, das vom Alkohol stammt. Das sich an diesem Atom befindliche Wasserstoff-Ion wandert zu einer Hydroxid-Gruppe, womit sich auch der Aufenthaltsort der Ladung ändert. Nun erfolgt die Wasserabspaltung. Dabei wird ein Bindungselektronenpaar zu einem freien Elektronenpaar. Das entstehende Kation trägt die Ladung erneut am zentralen Kohlenstoffatom. Ein freies Elektronenpaar des Sauerstoffatoms aus der Hydroxid-Gruppe bildet ein Bindungselektronenpaar. Somit trägt nun dieses Sauerstoffatom die positive Ladung. Nach Abspaltung des Protons liegt der Ester vor.
- Das von der Säure stammende Proton wird am Ende der Reaktion abgespalten und kann nun wieder genutzt werden. (Zur Erinnerung: Katalysatoren werden nicht verbraucht.)
- Als Nebenprodukt entsteht Wasser. Dieses kann zum Beispiel durch einen Wasserabscheider entfernt werden, wodurch das Gleichgewicht der Reaktion auf die Produktseite verschoben wird. So erhöht sich die Ausbeute am gewünschten Reaktionsprodukt.
-
Vervollständige die Wortgleichungen zur Bildung der Ester.
TippsAus dem Namen des Esters lassen sich die Edukte ablesen.
Über die Edukte kann man auch den Namen des Produktes bestimmen.
LösungAls Fruchtester bezeichnet man Ester kurzer Alkohole und Carbonsäuren. Sie kommen neben Parfüm auch in Lippenbalsam oder Salben zum Einsatz. Bonbons, Joghurt und Getränke sind Lebensmittel, in denen sie ebenfalls Anwendung finden.
Aus dem Namen des Esters lassen sich der Alkohol und die Carbonsäure ableiten.
In der ersten Reaktionsgleichung entsteht Ethansäurepenthylester. Der erste Teil des Namens bezeichnet dabei das erste Edukt: Ethansäure. „-penthyl-“ bezeichnet in diesem Fall den Alkyl-Rest, der nach der Reaktion vom Alkohol übrig bleibt. Hier muss also der Alkohol 1-Penthanol als Lösung eingetragen werden. Wasser entsteht als Nebenprodukt und wird auf der Produktseite eingesetzt.
Um einen Ester herzustellen, der nach Apfel riecht, lässt man Methanol und Butansäure reagieren. Der Name des entstehenden Esters setzt sich aus dem Namen der Säure (Butansäure) und dem Alkyl-Rest des Alkohols (-methyl) sowie dem Anhang -ester zusammen. Als Lösung erhält man Butansäuremethylester. Das Nebenprodukt Wasser wird auch hier wieder auf der Produktseite eingefügt.
In Reaktionsgleichung drei ist erneut der Name des Esters angegeben: Butansäurepropylester. Er riecht nach Erdbeere. Hier geht man erneut so wie bei der Herstellung des Bananen-Esters vor. Den ersten Teil des Namens gibt der Ester wieder: Butansäure. Der Alkyl-Rest (-propyl) des Esters gibt uns den Alkohol an: 1-Propanol. Rechts vom Reaktionspfeil muss noch das zweite Produkt, nämlich Wasser, eingetragen werden.
Nach Orange riecht der Ethansäureoctylester. Um die Ausgangsstoffe zu bestimmen, nutzen wir die Vorgehensweise von Reaktionsgleichung zwei. Den ersten Teil der Esterbezeichnung beinhaltet die Säure: Ethansäure. Über den Alkyl-Rest -octyl lässt sich auf den Alkohol schließen: 1-Octanol. Wasser wird dann auf der Produktseite in die Lücke eingetragen.
-
Erstelle die Reaktionsgleichung für die Synthese von Ethansäuremethylester.
TippsBestimme zuerst die Edukte, die an der Reaktion beteiligt sind.
Erinnere dich an die Schritte der Veresterung.
Beachte die Umlagerung von Atomen und die Bildung verschiedener Kationen.
LösungEthansäure ($CH_3COOH$) wird auch Essigsäure genannt. Diese Carbonsäure ist ätzend, flüssig und farblos. Sie ist am Gleichgewichtsschritt 1 beteiligt. An das Sauerstoffatom mit der Doppelbindung zum zentralen Kohlenstoffatom lagert sich das Proton an. Nach Umlagerung eines Bindungselektronenpaars zu einem freien Elektronenpaar am Sauerstoffatom entsteht ein Kation mit der Ladung am zentralen Kohlenstoffatom. Jetzt kann sich der Alkohol anlagern. Hier ist es Methanol ($CH_3OH$), welcher unter Normalbedingungen eine leicht flüchtige, farblose und entzündliche Flüssigkeit ist. Dabei lagert sich ein freies Elektronenpaar des Sauerstoffs der Hydroxid-Gruppe um zum zentralen Kohlenstoffatom des Kations. Das Proton des Alkohols lagert sich dann um zu einem der Sauerstoffatome der Carbonsäure. Das so entstandene Kation trägt die positive Ladung nun an dem Sauerstoffatom, das zwei Wasserstoffatome trägt. Im nächsten Schritt erfolgt die Abspaltung des Wassermoleküls. Das daraufhin gebildete Kation trägt die Ladung am zentralen Kohlenstoffatom. Vom übrig gebliebenen Sauerstoffatom der Carbonsäure lagert sich ein freies Elektronenpaar um zum Bindungselektronenpaar. Zwischen dem zentralen Kohlenstoffatom und besagtem Sauerstoffatom liegt nun eine Doppelbindung vor. Die positive Ladung trägt das Sauerstoffatom. Im letzten Schritt spaltet sich das Proton des Sauerstoffatoms ab und der Ester liegt vor.
-
Vergleiche die zwei Synthesevarianten der Ester.
TippsDer Katalysator muss bei der azeotropen Veresterung zwar sauer sein, ist aber nicht wasserentziehend.
LösungZu den wasserentziehenden Mitteln gehören neben Schwefelsäure auch Diphosphorpentoxid und Alkohol (absolut). Schwefelsäure ist eine der stärksten Säuren. Sie gibt sehr leicht Protonen ab, weshalb sich mit Wasser Hydronium-Ionen bilden.
$H_2SO_4$ + $H_2O$ $\longrightarrow$ ${HSO_4}^-$ + $H_3O^+$
Diphosphorpentoxid hat die Summenformel $P_4O_{10}$. Der Stoff kann viel Wasser aufnehmen. Bei dieser Reaktion wird viel Wärme frei, d.h. sie ist exotherm.
Bruttogleichung: $P_4O_{10}$ + $6 H_2O$ $\longrightarrow$ $ 4~H_3PO_4$
Der Alkohol muss bei diesem Syntheseverfahren wasserfrei (absolut) sein, denn wir wollen Wasser entziehen.
Bei der azeotropen Veresterung kann man das Prinzip vom kleinsten Zwang nutzen. Es besagt: Ändert man die äußeren Bedingungen eines sich im chemischen Gleichgewicht befindlichen Systems, so stellt sich (dem Zwang ausweichend) ein neues Gleichgewicht ein. In diesem Fall wird eines der Produkte entfernt: Wasser. Dadurch verschiebt sich das Gleichgewicht zu den Produkten hin. Die Ausbeute am gewünschten Produkt ist somit sehr hoch.
Destillation ist eine weitere Möglichkeit, ein Reaktionsprodukt abzutrennen. Diese Methode nutzt man schon seit dem Altertum. Dabei werden die unterschiedlichen Siedepunkte der Flüssigkeiten ausgenutzt. Durch anschließendes Kondensieren erhält man ein Destillat, was aus nur einem der zu trennenden Stoff besteht.
Toluol ist eines der Lösungsmittel, ein weiteres Lösungsmittel ist Chloroform.
-
Analysiere die wasserentziehenden Mittel.
TippsÜberlege, was du über die Stoffe bereits weißt.
Erinnere dich an die Definition von Säuren, um die Reaktionsgleichungen zu lösen.
LösungEine der stärksten Säuren ist die Schwefelsäure. Über sie werden die Supersäuren definiert: Säuren, die stärker sind als Schwefelsäure. Wassermoleküle zu binden gehört zu den Eigenschaften der Schwefelsäure. Dabei kann ein Molekül der Säure acht Moleküle Wasser binden. Das entstandene Hydrat kann als Kristallwasser dargestellt werden:
$H_2SO_4$ + $8~H_2O$ $\longrightarrow$ $H_2SO_4 \cdot 8~H_2O$
Um die Protolysestufen darzustellen, muss man sich an die Eigenschaft von Säuren erinnern: Sie geben Protonen ab. Die Wassermoleküle bilden mit diesen die Hydronium-Ionen ($H_3O ^+$). Das entstehende ${HSO_4} ^{\, -}$ wird als Hydrogensulfat bezeichnet.
Erste Protolysestufe:
$H_2SO_4$ + $H_2O$ $\longrightarrow$ $ {HSO_4} ^{\, -}$ + $H_3O ^+$
In der zweiten Protolysestufe gibt das Hydrogensulfat-Ion sein letztes Proton ab, weshalb sich das Sulfat-Ion bildet:
${HSO_4} ^{\, -}$ + $H_2O$ $\longrightarrow$ $ {SO_4} ^{2-}$ + $H_3O ^ +$
Diphosphorpentoxid ist als historische Bezeichnung erhalten geblieben. Später stellte man fest, dass ein Molekül dieser Verbindung besser beschrieben wird durch die Summenformel $P_4O_{10}$. Phosphorpentoxid kann viel Wasser aufnehmen. Dies erfolgt über mehrere Stufen unter Bildung verschiedener Phosphorsäuren. Wichtig zu wissen ist hier vorgestellte Bruttoreaktionsgleichung: Vorgegeben ist dabei nur das Reaktionsprodukt. Das erste Edukt lässt sich aus dem Text entnehmen: Tetraphosphordecaoxid ($P_4O_{10}$). Auf Seiten der Produkte sind vier $P$-Atome enthalten, ebenso wie bei den Edukten. Hier muss also nicht mehr ausgeglichen werden. Nun müssen wir noch die Zahl vor den Wassermolekülen (Edukt) bestimmen. Auf Seiten der Edukte befinden sich zwölf Wasserstoff- und sechs Sauerstoffatome. Somit ist die einzutragende Lösung: $6 H_2O$.
$P_4O_{10}$ + $6~H_2O$ $\longrightarrow$ $ 4~H_3PO_4$
Um feste Reaktionsprodukte zu trocknen, nutzt man einen Exsikkator (siehe Bild). Dieser enthält im unteren Bereich das entsprechende Trocknungsmittel. Mit Hilfe des Deckels kann das Glasgefäß luftdicht verschlossen werden. Das Trocknungsmittel entzieht der Luft dabei die Feuchtigkeit, die zuvor von der zu trocknenden Substanz abgegeben wurde. Als Trocknungsmittel können ebenfalls Calciumchlorid oder Kieselgel verwendet werden.
7.712
sofaheld-Level
6.601
vorgefertigte
Vokabeln
7.923
Lernvideos
37.093
Übungen
34.330
Arbeitsblätter
24h
Hilfe von Lehrer*
innen

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff


 Du möchtest schneller & einfacher lernen?
Du möchtest schneller & einfacher lernen?

 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen


















R1 und R2 sind organische Reste, meist Alkyle, also Methyl, Ethyl, Propyl, usw. Die verschiedenen Indizes heißen lediglich, dass die Reste nicht zwangsläufig gleich sein müssen. Aber auch R1 = R2 ist möglich.
Hinter Resten können sich aber auch aromatische Fragmente wie Phenyl (vom Benzol abgeleitet) oder Benzyl (Phenylmethyl) verbergen.
Alles Gute
Wofür steht das R2 im Alkoholmolekül bzw. was unterscheidet es vom R1?
Ich hätte gerne Zugriff auf die Textversion ?
Wäre es möglich diese Wiederherzustellen ?
Ich hoffe, es hat geholfen!
Alles Gute
vielen Dankich bin zwar erst 10. Klasse aber habe den groeßten teil verstanden, und werde morgen den chemietest verstehen, und eine 2 schreiben :)