Quantenchemische Betrachtungen des Atomaufbaus
Die Aufgabe eines Atommodells ist es Fragen zu beantworten. Das Orbitalmodell beantwortet viele davon.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Orbitalmodell
Bei dem Orbitalmodell handelt es sich um eine Weiterentwicklung der davor bekannten Atommodelle. Die Entdeckung der Quantenmechanik machte das Orbitalmodell erst möglich. Es zeigte sich, dass sich kleinste Teilchen nicht ausschließlich nach den Gesetzmäßigkeiten der klassischen Physik verhielten. So konnte das Doppelspaltexperiment zeigen, dass auch Elektronen sowohl Teilchen- als auch Welleneigenschaften aufweisen. Daher lässt sich jedes Elektron durch eine ganz bestimmte Wellenfunktion $\Psi$ beschreiben.
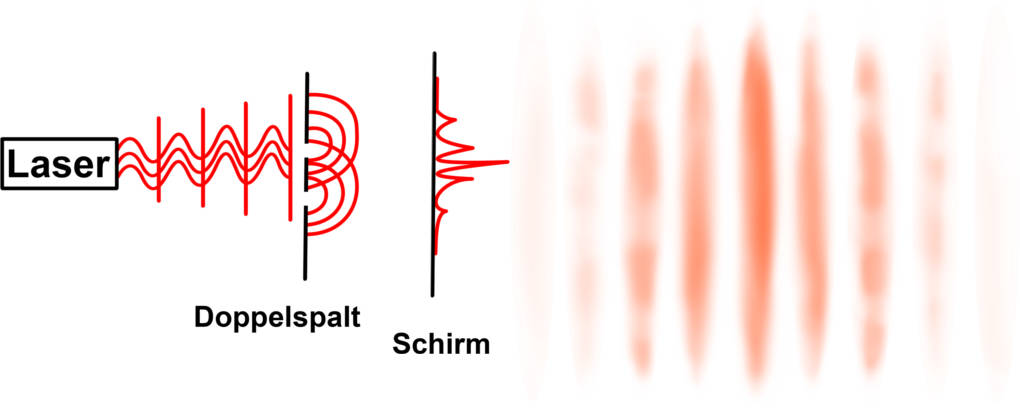
Aus dieser Beobachtung resultierte die Heisenbergsche Unschärferelation. Diese besagt, dass zwei Messgrößen nicht mit gleich hoher Messgenauigkeit bestimmbar sind. So kann z.B. für ein Elektron nicht gleichzeitig Ort und Geschwindigkeit genau bestimmt werden. Im Orbitalmodell wird daher den Elektronen eine Aufenthaltswahrscheinlichkeit zugeordnet und kein genauer Ort, da man nicht genau bestimmen kann, wo sie sich befinden. Die Geschwindigkeit und damit die Energie, die das Elektron trägt, kann dafür aber genauer bestimmt werden. So ist das Energieniveau bekannt, wodurch sich ein Elektron einer Schale und einem Orbital (Wahrscheinlichkeitsraum) zuordnen lässt.
Das Orbital
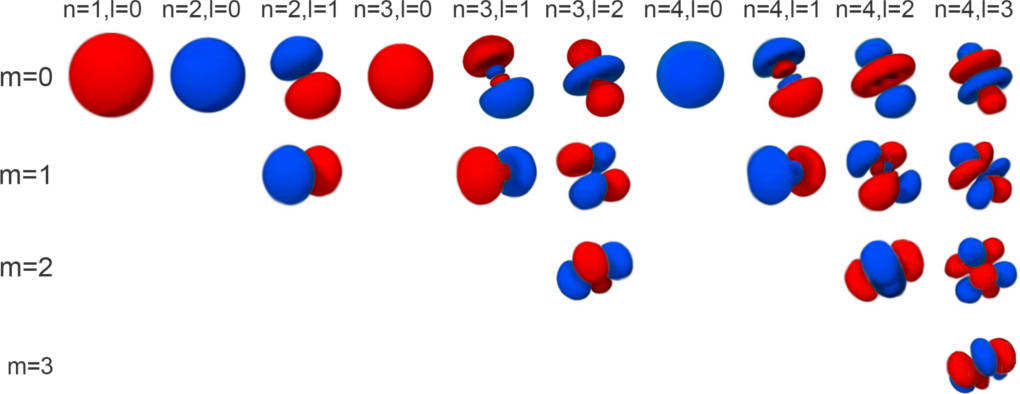
Ein Atomorbital stellt in diesem Modell nur den Ort der höchsten Aufenthaltswahrscheinlichkeit dar. Pro neue Elektronenschale kommen neue Orbitale hinzu. Jedes einzelne Orbital beinhaltet bis zu zwei Elektronen. Diese weisen entgegengesetzte Spins auf. Es gibt in der ersten Schale nur das s-Orbital. Dieses Orbital ist kugelförmig. In der zweiten Schale kommen dann die hantelförmigen p-Orbitale hinzu. Es gibt drei p-Orbitale, die auf die Raumachsen (x, y, z) verteilt sind. In der dritten Schale gibt es zusätzlich fünf d-Orbitale. Ihr räumlicher Aufbau ist schon deutlich komplexer als bei den s- und p-Orbitalen. Ein d-Orbital zeigt eine Rosettenform.
Quantenzahlen
Die Quantenzahlen dienen dazu, Elektronen zu charakterisieren. Sie geben an, in welchem Orbital sich die Elektronen befinden. Dabei unterscheiden sich alle Elektronen eines Atoms oder Ions in mindestens einer Quantenzahl (Pauli-Prinzip). Ein Elektron wird durch 4 Quantenzahlen genau beschrieben. Dies sind die Hauptquantenzahl, die Nebenquantenzahl, die Magnetquantenzahl und die Spinquantenzahl.
Die Hauptquantenzahl besitzt das Symbol $n$. Sie gibt das grundlegende Energieniveau und damit die Schale des Elektrons an. Sie kann eine natürliche Zahl größer 0 annehmen.
Die Nebenquantenzahl $l$ (auch Drehimpulsquantenzahl) gibt die Form des Orbitals an. Diese Quantenzahl kann eine natürliche Zahl einschließlich 0 sein. Die 0 steht für das s-Orbital, die 1 für das p-Orbital, die 2 für das d-Orbital und so weiter. Dabei ist die Nebenquantenzahl immer mindestens 1 kleiner als die Hauptquantenzahl. Daran kannst du auch erkennen, dass es in der ersten Schale nur ein s-Orbital gibt. In der zweiten Schale ist ein s- und ein p-Orbital möglich. Mit steigender Hauptquantenzahl kann als auch die Nebenquantenzahl immer größer werden.
Die Magnetquantenzahl $m_l$ gibt Auskunft über die räumliche Orientierung des Orbitals, in dem sich das Elektron befindet. Sie darf betragsmäßig nicht größer sein als die Nebenquantenzahl. Sie kann also natürliche Werte zwischen $-l$ und $l$ annehmen, dabei ist auch die 0 möglich. Die Magnetquantenzahl gibt Auskunft über zusätzliche potentielle Energie im Magnetfeld in z-Richtung.
Die letzte der vier Quantenzahlen ist die Spinquantenzahl $s$. Sie gibt die Orientierung des Spins eines Elektrons an und kann $\frac{1}{2}$ und $- \frac{1}{2}$ annehmen. Elektronen, die sich im gleichen Orbital aufhalten, also drei gleiche Quantenzahlen haben, müssen sich in dieser Spinquantenzahl unterscheiden (Pauli-Prinzip). Sie besitzen also entgegengesetzte Spins.
Elektronenkonfiguration
Die Elektronenkonfiguration stellt die Verteilung der Elektronen eines Atoms oder Ions auf die Orbitale dar. In welchem Orbital ein bestimmtes Elektron zu finden ist, geben die vier Quantenzahlen an.
Die vorhandenen Orbitale werden, beginnend mit der niedrigsten Schale, mit Elektronen besetzt. Gemäß der Hundschen Regel werden alle Orbitale gleicher Energie zuerst einfach besetzt und dann aufgefüllt. Die äußerste, besetzte Schale wird auch als Außenschale (Valenzschale) bezeichnet. Die Anzahl der Außenelektronen bestimmt das chemische Verhalten des Elements und ist daher Maßstab für die Einordnung ins Periodensystem (PSE). Ein Beispiel für eine Elektronenkonfiguration siehst du hier.
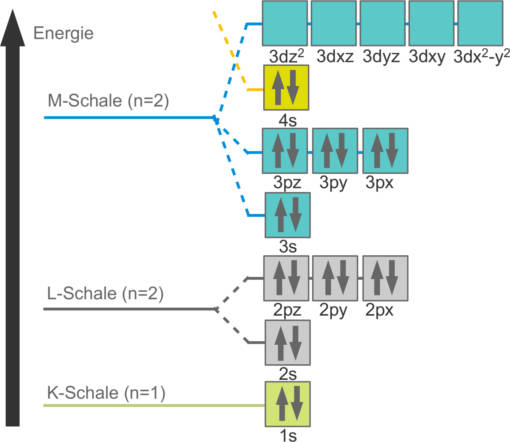
Dies ist die Konfiguration für Calcium. Das kannst du an den zwei Außenelektronen und den vier Schalen sehen. Es gibt hier eine Besonderheit. Das 4s-Orbital liegt energetisch unter dem 3d-Orbital und wird daher zuerst besetzt.
Alle Videos zum Thema
Videos zum Thema
Quantenchemische Betrachtungen des Atomaufbaus (7 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Quantenchemische Betrachtungen des Atomaufbaus (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff












 Quantenzahlen
Quantenzahlen
 Quantenzahlen – K-Schale bis N-Schale
Quantenzahlen – K-Schale bis N-Schale
 Ermittlung der Elektronenkonfiguration
Ermittlung der Elektronenkonfiguration
 Elektronenkonfiguration
Elektronenkonfiguration
 Atomorbitale
Atomorbitale
 Molekülorbitale
Molekülorbitale
 Hybridisierung am Beispiel von Methan
Hybridisierung am Beispiel von Methan









