Struktur und Systematik bei organischen Verbindungen
Es gibt mehr als 40 Millionen strukturell unterschiedliche organische Verbindungen, um den Überblick zu behalten bedarf es der systematischen Benennung.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Organische Chemie
Die organische Chemie ist eins der großen Teilgebiete der Chemie. Sie wird auch als Kohlenstoffchemie bezeichnet, da organische Verbindungen auf einem Kohlenstoffgerüst beruhen.
Es zählen aber nicht alle Kohlenstoffverbindungen zur Organik. So sind die Kohlenstoffoxide $(CO,~CO_2)$, Carbonate, Kohlensäure, Cyanide, elementare Formen (Graphit, Diamant) und einige andere Stoffe Teil der Anorganik.

Es gibt eine riesige Fülle an organischen Verbindungen. Es sind heutzutage über 40 Millionen Verbindungen bekannt. Diese große Anzahl kommt durch die Verknüpfungsmöglichkeiten von Kohlenstoff zustande.
Kohlenstoff kann Bindungen mit sich selbst eingehen. Dadurch kann Kohlenstoff Ketten, Ringe und dreidimensionale Strukturen bilden. Der Hauptteil der organischen Stoffe besteht nur aus vier Grundelementen. Dies sind Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff. Wie kann man in dieser riesigen Menge aber den Überblick behalten?
Nomenklatur von Kohlenwasserstoffen
Wie sieht die Nomenklatur von funktionellen Kohlenwasserstoffen aus? Um Verbindungen der organischen Chemie zweifelsfrei benennen und identifizieren zu können, führte die International Union of Pure and Applied Chemistry (IUPAC) allgemeine Regeln für die Benennung ein. Dies ist die Nomenklatur.
Bevor die Nomenklatur entwickelt wurde, war es für Forscher überaus schwierig, anderen ihre Ergebnisse mitzuteilen. Da organische Moleküle mitunter sehr groß und komplex sind, war eine exakte Benennung unbedingt nötig, da sonst andere Forscher nicht erkennen konnten, um was für eine Verbindung es sich handelte.
Um eine organische Verbindung nun exakt zu benennen, muss man einige Regeln kennen und befolgen. Dann kann man sogar solch eine komplexe Struktur benennen.
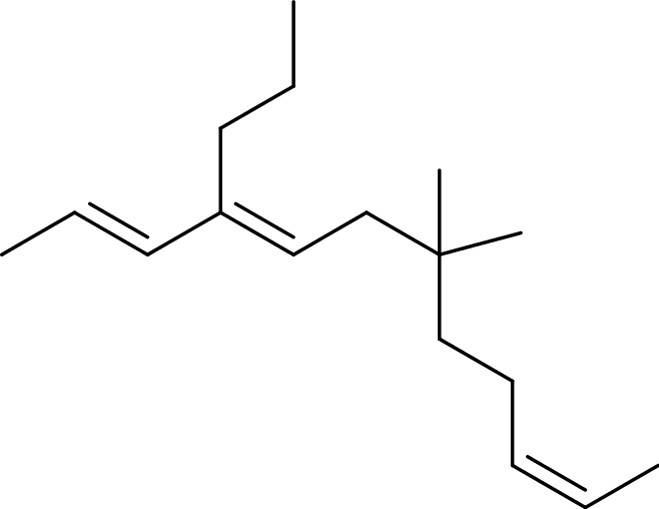
Zuerst sucht man die längste Kette. Diese wird dann durchnummeriert. Die Anzahl der Kohlenstoffatome bestimmt den Hauptnamen der Verbindung. Die Nummern werden benötigt, um genau zu bestimmen, an welchen Stellen Seitenketten und funktionelle Gruppen sitzen.
Die Nummerierung erfolgt so, dass die Nummern für die Seitenketten und funktionellen Gruppen möglichst klein sind (Prinzip der kleinsten Zahl). Es werden nun die Seitenketten benannt, dann mit der Nummer des Kohlenstoffatoms bezeichnet, an das sie gebunden sind und alphabetisch geordnet an den Anfang des Namens der organischen Verbindung geschrieben. Es folgt der Hauptname (Anzahl C-Atome in längster Kette) und am Schluss die Endung für die funktionellen Gruppen mit Nummern. Hier siehst du die Kette und die Seitenketten hervorgehoben.
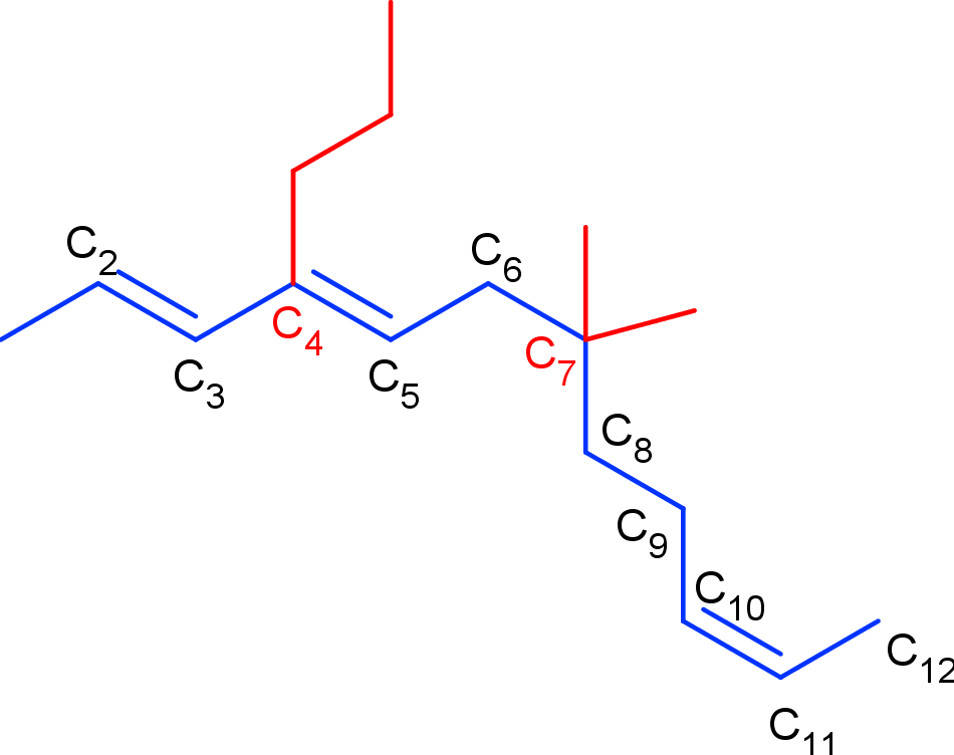
Befolgst du diese Regeln, ergibt sich der Name 7,7-Dimethyl-4-propyl-dodeca-2,4,10-trien. Auf diese Weise kann genau zugeordnet werden, an welcher Stelle im Molekül sich Seitenketten und funktionelle Gruppen, wie in diesem Fall die Doppelbindungen, befinden. Es gibt aber noch weitaus mehr funktionelle Gruppen.
Funktionelle Gruppen
Funktionelle Gruppen sind Atome oder Atomgruppen, die die Eigenschaften von Verbindungen maßgeblich beeinflussen. Durch sie ist eine Systematik in der organischen Chemie möglich. Die funktionellen Gruppen lassen eine Zuordnung zu Stoffklassen zu.
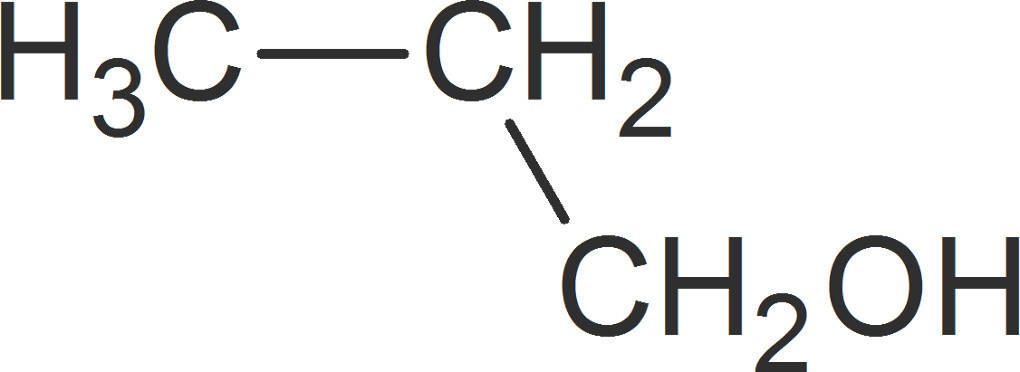
Eine Stoffklasse beinhaltet Stoffe, die dieselbe funktionelle Gruppe tragen und dadurch in einigen Punkten vergleichbare Eigenschaften aufweisen. Diese Stoffe besitzen eine charakteristische Endung, die auf die enthaltene funktionelle Gruppe hinweist. So besitzen Alkohole die Hydroxyl-Gruppe $-OH$. Aus diesem Grund erhalten sie die Endung -ol. Ein Alkohol mit drei Kohlenstoffatomen besitzt folglich den Namen Propanol.
Es gibt viele verschiedene funktionelle Gruppen in der organischen Chemie. Hier seien einige von ihnen aufgeführt. Die Stoffklasse der Carbonsäuren besitzt die Carboxy-Gruppe $-COOH$. Sie enden auf -säure (z.B. Ethansäure). Daraus abgeleitet sind die Ester. Die Ester-Gruppe $-COO-$ verbindet zwei organische Reste miteinander. Amine weisen die Amino-Gruppe $-NH_2$ auf.
Mit dem Element Sauerstoff sind noch weitere funktionelle Gruppen möglich. So besitzen die Ketone die Keto-Gruppe $-C=O-$. Die Carbonyl-Gruppe $(C=O)$ ist dabei von zwei organischen Resten eingeschlossen. Sie erhalten die Endung -on. Die Aldehyde besitzen an der Carbonyl-Gruppe keinen zweiten organischen Rest, sondern nur ein Wasserstoffatom. Die Aldehyd-Gruppe ist daher $-CHO$. Alkane mit Aldehydgruppe werden systematisch als Alkanale bezeichnet und erhalten deswegen die Endung -al.
Doppel- und Dreifachbindungen stellen ebenfalls funktionelle Gruppen dar. Es handelt sich dabei um die Stoffklasse der Alkene (Doppelbindung, Endung -en) und der Alkine (Dreifachbindung, Endung -in).
Isomerien
Isomerie bedeutet, dass sich Stoffe in ihrer Zusammensetzung nicht unterscheiden, sie also die gleiche Summenformel besitzen, aber Unterschiede in der Struktur aufweisen. Auch besitzen die Isomere eine unterschiedliche Wirkung auf Organismen. So kann ein Isomer ein Heilmittel und das andere Isomer ein gesundheitsschädlicher Stoff sein.
So kann sich die funktionelle Gruppe an unterschiedlichen Stellen im Molekül befinden. Zwei funktionelle Gruppen können sich entweder auf der gleichen Seite oder gegenüber befinden. Dies wird als cis/trans-Isomerie bezeichnet.
Auch die Mesomerie ist eine Art der Isomerie, bei der sich die Elektronen verschieden im Molekül verteilen. Verhalten sich zwei Verbindungen wie Bild und Spiegelbild, spricht man von Enantiomerie. Damit verbunden ist das Phänomen der Chiralität. Dabei wird polarisiertes Licht von den Enantiomeren unterschiedlich gedreht.
Die Struktur und Systematik in der organischen Chemie ist sehr komplex und umfangreich. Wenn man aber die Regeln der Nomenklatur kennt, kann man sich gut in ihr zurechtfinden.
Alle Videos zum Thema
Videos zum Thema
Struktur und Systematik bei organischen Verbindungen (15 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Struktur und Systematik bei organischen Verbindungen (11 Arbeitsblätter)
-
 Organische Chemie – vier Grundelemente und Definition
PDF anzeigen
Organische Chemie – vier Grundelemente und Definition
PDF anzeigen -
 Die organische Chemie – ein Gigant
PDF anzeigen
Die organische Chemie – ein Gigant
PDF anzeigen -
 Funktionelle Gruppen in der organischen Chemie
PDF anzeigen
Funktionelle Gruppen in der organischen Chemie
PDF anzeigen -
 Nomenklatur funktioneller Kohlenwasserstoffe
PDF anzeigen
Nomenklatur funktioneller Kohlenwasserstoffe
PDF anzeigen -
 Zusammenhänge zwischen Eigenschaften und Molekülstruktur bei organischen Verbindungen
PDF anzeigen
Zusammenhänge zwischen Eigenschaften und Molekülstruktur bei organischen Verbindungen
PDF anzeigen -
 Zusammenhänge zwischen pH-Wert und Molekülstruktur bei organischen Verbindungen
PDF anzeigen
Zusammenhänge zwischen pH-Wert und Molekülstruktur bei organischen Verbindungen
PDF anzeigen -
 Chiralität und optische Aktivität
PDF anzeigen
Chiralität und optische Aktivität
PDF anzeigen -
 I-Effekt und M-Effekt
PDF anzeigen
I-Effekt und M-Effekt
PDF anzeigen -
 Sterischer Effekt – Einfluss auf den Reaktionsverlauf
PDF anzeigen
Sterischer Effekt – Einfluss auf den Reaktionsverlauf
PDF anzeigen -
 Racemat und Racematspaltung
PDF anzeigen
Racemat und Racematspaltung
PDF anzeigen -
 Chirale Verbindungen in R/S-Nomenklatur
PDF anzeigen
Chirale Verbindungen in R/S-Nomenklatur
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff




























