Die III. und IV. Hauptgruppe
Die Erdmetalle und die Gerüstbildner.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Was ist die dritte Hauptgruppe?
- Bor
- Aluminium
- Seltene Erden
- Was ist die vierte Hauptgruppe?
- Kohlenstoff
- Silicium
- Germanium, Zinn und Blei
Was ist die dritte Hauptgruppe?
Die dritte Hauptgruppe des Periodensystems der Elemente, auch Borgruppe genannt, beinhaltet fünf Elemente. Dies sind Bor, Aluminium, Gallium, Indium und Thallium. Sie werden auch als Erdmetalle bezeichnet. Dabei wird der metallische Charakter nach unten hin immer stärker. Dies äußert sich darin, dass auch der basische Charakter der entsprechenden Hydroxide in diese Richtung zunimmt. Die Dichte nimmt von Bor bis zum Thallium stetig zu.
Bor
Außer Bor sind in dieser Gruppe nur Metalle vertreten. Bor nimmt in dieser Gruppe als Halbmetall eine Sonderstellung ein. Es kommt in verschiedenen Modifikationen vor. Davon gibt es welche, bei denen der metallische Charakter vorherrschend ist, aber auch welche, bei denen der nichtmetallische Charakter überwiegt. Bor ist äußerst selten zu finden. Es kommt in der Natur gebunden in Mineralien, wie dem Borax $Na_2B_4O_7\cdot~10~H_2O$, vor. Reines Bor kann durch die Umsetzung von Bortrioxid $B_2O_3$ mit Magnesiumpulver gewonnen werden. Bor, in seiner metallischen Modifikation, besitzt die größte Zugfestigkeit aller Elemente und eine Härte, die fast an die von Diamant heranreicht. Aus diesem Grund wird es für Bauteile, die besonderen Belastungen standhalten müssen, verwendet, wie z.B. Hubschrauberteile.

Aluminium
Aluminium ist schon weit häufiger anzutreffen. 8,2 % der Erdkruste besteht aus Aluminium. Als unedles Metall liegt es in der Natur natürlich nicht elementar vor, sondern in stabilen Verbindungen. Aluminiumoxid $Al_2O_3$ ist ein wichtiger Bestandteil von Tonerde. Im Mineral Korund ist ebenfalls Aluminium enthalten. Durch bestimmte Verunreinigungen des Korunds entstehen Edelsteine wie Rubin und Saphir.

Andere wichtige Aluminiumminerale sind Bauxit und Kryolith. Aluminium ist eines der wichtigsten Leichtmetalle unserer Zeit. Beispielhaft für die Gewinnung der Erdmetalle kannst du dir die Gewinnung von Aluminium aus Bauxit anschauen. Zur Herstellung wird das Mineral Bauxit benutzt, da es in ausreichender Menge abgebaut werden kann. Dieses wird in Aluminiumoxid überführt $(Al_2O_3)$. Um nun elementares Aluminium zu gewinnen, wird das Oxid geschmolzen. Die Ionen der Verbindung werden so frei beweglich. Die Schmelze wird dann elektrolysiert. Doch welche Elektrolyse ist es genau? Man spricht von einer Schmelzflusselektrolyse. Dabei werden die Aluminium-Ionen reduziert und es entsteht elementares Aluminium. Es wird heutzutage für Bauteile verwendet, gerade im Automobilbau, da es sehr leicht ist. Außerdem kommt es in der Elektrotechnik zum Einsatz. Viele Behälter und Verpackung bestehen aus Aluminium.
Seltene Erden
Gallium, Indium und Thallium kommen äußerst selten vor und werden daher auch als seltene Erden bezeichnet. Sie liegen ebenso wie Aluminium in Verbindungen in der Natur vor. Sie zu finden und abzubauen, ist ein schwieriger und aufwendiger Prozess. Gallium wird aufgrund seiner Seltenheit nur wenig verwendet. Es kommt aber zur Dotierung, in besonderen Thermometern und in Solarzellen zum Einsatz. Indium wurde früher gern als Schutzbeschichtung von Metallen benutzt. Der Preisanstieg bedingt durch die Seltenheit macht dies aber nicht mehr wirtschaftlich. Thallium findet unter anderem Verwendung in der Optik und in Fotozellen. Thallium weist eine außergewöhnlich hohe Dichte auf.
Was ist die vierte Hauptgruppe?
In der vierten Hauptgruppe des PSE befinden sich Kohlenstoff, Silicium, Germanium, Zinn und Blei. Diese Elemente besitzen vier Außenelektronen und stehen so direkt in der Mitte des PSE. Um eine stabile Form anzunehmen, können vier Elektronen aufgenommen oder vier abgegeben werden. Da gerade die Nichtmetalle dieser Gruppe große Strukturen bauen, nennt man die Gruppe auch Gerüstbildner. Die Dichte nimmt in der Gruppe nach unten hin zu. Dahingegen nehmen die Härte nach Mohs sowie Schmelz- und Siedepunkt von oben nach unten ab.
Kohlenstoff
Kohlenstoff ist das einzige Nichtmetall der Gruppe und kann vier Bindungen eingehen. Damit ist es Ausgangspunkt der organischen Chemie, da sich räumliche Kohlenstoffnetzwerke bilden können. Kohlenstoff ist als Diamant das härteste natürliche Mineral, als Graphit jedoch eines der weichsten Minerale. Kohlenstoff ist in jedem organischen Stoff vertreten. In Reinform wird es als Brennstoff gebraucht und Kohlenstoffröhren finden Anwendung in Bauteilen als Carbon-Verbundwerkstoffe.
Silicium
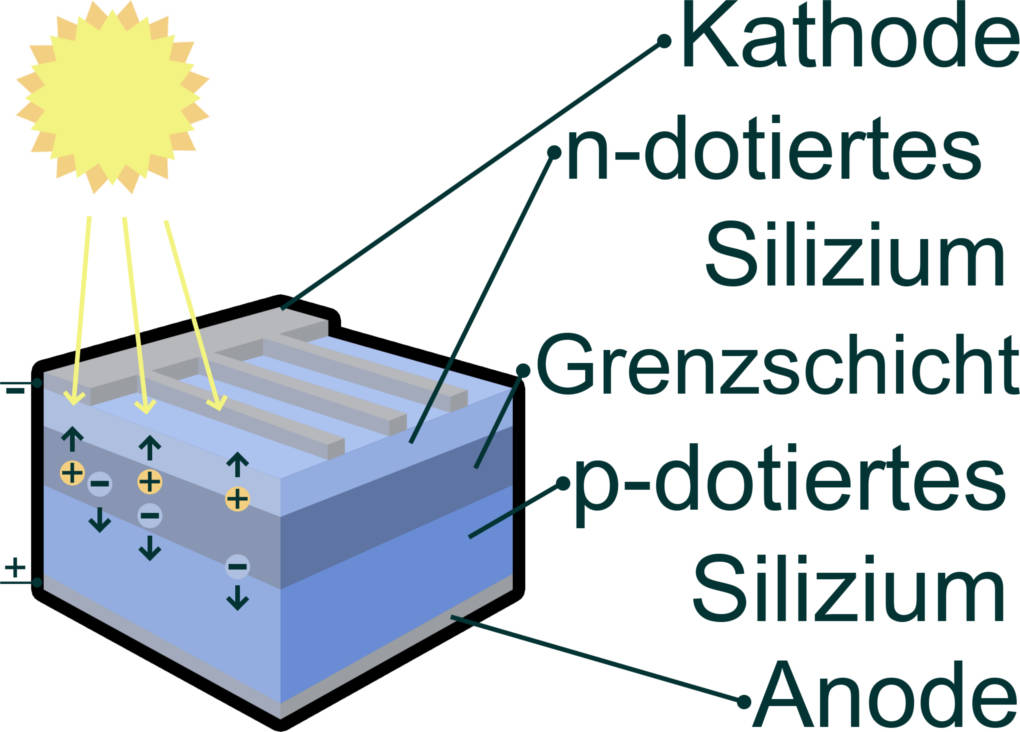
Silicium wird zumeist als Halbmetall angesehen. Es steht von seinen Eigenschaften her zwischen den Nichtmetallen und den Metallen. Auch Silicium kann räumliche Strukturen, die Silane, bilden. Silicium kommt in der Erdkruste sehr häufig vor. Es wird viel in der Elektronik und Photovoltaik eingesetzt.
Germanium, Zinn und Blei
Germanium ist ein seltenes Metall. Es wurde vor Silicium in der Halbleitertechnik eingesetzt, hat dort aber heute an Bedeutung verloren. Die weiteren Mitglieder der Kohlenstoffgruppe sind allesamt Metalle. Zinn wird noch oft als Metallüberzug genutzt, früher wurden Teller, Besteck und auch Kunstwerke von Zinngießern hergestellt. Zinn ist zudem ein Bestandteil von Bronze und war gerade in der gesamten Bronzezeit ein sehr wichtiges Metall. Blei wird vorwiegend in Legierungen eingesetzt, dient aber wegen seiner hohen Elektronendichte und Dichte als Schutzmantel gegen radioaktive Strahlung und Röntgenstrahlung.
Alle Videos zum Thema
Videos zum Thema
Die III. und IV. Hauptgruppe (2 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Die III. und IV. Hauptgruppe (1 Arbeitsblatt)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff







 IV. Hauptgruppe – Überblick
IV. Hauptgruppe – Überblick









