Chemische Formeln und Reaktionen
Chemische Formeln drücken das Verhältnis von Elementen in einer Verbindung aus. Läuft eine chemische Reaktion ab, ist diese immer verbunden mit Stoff- und Energieumwandlung.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Symbole und Formeln
Chemische Elemente sind bereits seit dem Altertum bekannt. So wurden Metalle aus Erzen gewonnen und die Alchemisten experimentierten bereits mit Schwefel und Quecksilber. Es fehlten allerdings eine Ordnung und einheitliche Bezeichnungen der Elemente und ihrer Verbindungen. So war ein Wissensaustausch sehr schwierig.
Aus diesem Grund wurden einheitliche Namen und Symbole für die chemischen Elemente festgelegt. Heute können wir diese dem Periodensystem der Elemente entnehmen. Aber bis zur Entwicklung dieses Instruments war es ein weiter Weg.
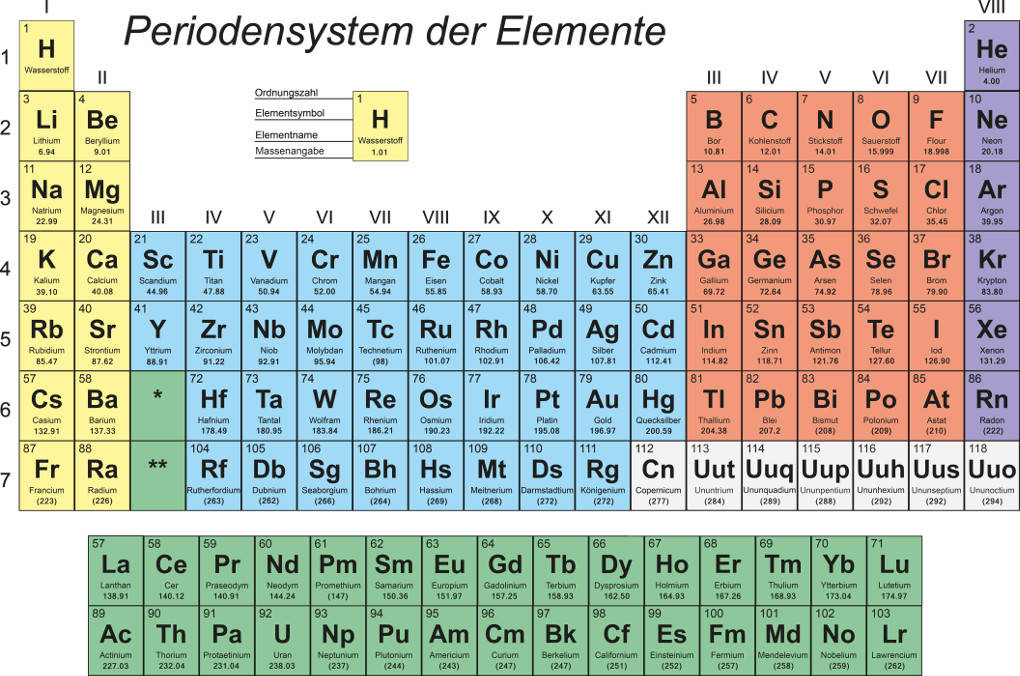
Berzelius leistete einen großen Beitrag zur Kommunikation der Forscher. Er führte die chemische Zeichensprache ein. So konnten die Elemente abgekürzt werden, was viel Zeit ersparte, und jeder verstand die Bedeutung dieser Symbole. Beispielsweise bekam Sauerstoff das Symbol O und Wasserstoff wurde mit H abgekürzt.
Aus den chemischen Symbolen konnte man nun auch Verbindungen der Elemente zusammensetzen. Dafür benötigt man Wissen um die Wertigkeiten und Oxidationszahlen. So hat Sauerstoff in Verbindungen fast immer die Oxidationszahl -2. Alkalimetalle (1 Hauptgruppe) besitzen die Oxidationszahl +1 in Verbindungen. Man kann nun die Formel für die elektrisch neutralen Alkalimetalloxide aufstellen.
Ox. O: -2
Ox. K: +1
$K_2O$
Beim Aufstellen von chemischen Formeln und vollständigen Reaktionsgleichungen gelten feste Regeln und Gesetze wie das Gesetz der konstanten Proportionen.
Chemische Reaktionen
Chemische Reaktionen laufen jeden Tag ständig um uns herum und auch in uns ab. So atmen wir Sauerstoff ein und Kohlendioxid wieder aus. In den Pflanzen läuft die Fotosynthese ab, die Grundlage der autotrophen und heterotrophen Ernährung, bei der sie das Kohlenstoffdioxid umwandeln in Sauerstoff und Zucker. Wenn du eine Kerze anzündest, hast du eine chemische Reaktion in Gang gesetzt.
An diesen Beispielen kannst du schon ein Wesensmerkmal von chemischen Reaktionen erkennen: die Stoffumwandlung.
Am Beispiel der Reaktion von Eisen mit Schwefel wird es deutlich. Die Ausgangsstoffe (Edukte) sind Eisen und Schwefel. Nach der Reaktion bleibt ein schwarzes Pulver zurück: das Eisensulfid. Das Sulfid ist weder metallisch glänzend wie Eisen noch gelb wie Schwefel. Es ist also ein neuer Stoff entstanden mit neuen Eigenschaften. Diese Reaktion kann man in einer Reaktionsgleichung aufstellen und darstellen.
$Fe + S \longrightarrow~FeS$

Energieumsatz
Ein weiteres Merkmal einer chemischen Reaktion ist der Energieumsatz. Wenn neue Bindungen geknüpft werden, damit neue Stoffe entstehen, wird entweder Energie frei oder Energie wird aufgenommen.
Sind die Edukte energiereicher als die Produkte, spricht man von einer exothermen Reaktion. Es wird Energie in Form von Wärme und/oder Licht frei. Das nutzen wir zum Beispiel zum Heizen.
Der entgegengesetzte Fall ist die endotherme Reaktion. Hier weisen die Edukte weniger Energie als die Produkte auf. Es wird im Reaktionsverlauf also Energie aus der Umgebung aufgenommen. Ein Beispiel dafür ist das Lösen von Kochsalz in Wasser.
Bei chemischen Reaktionen kommt es also zu einer Energieumwandlung. Die Energie geht dabei nicht verloren, sondern ändert nur die Erscheinungsform. So wird chemische Energie in Wärme- und Lichtenergie umgewandelt. Im Falle einer Batterie wird chemische Energie in elektrische umgewandelt. Es gilt also in jedem Fall der Energieerhaltungssatz.
Massenerhaltungssatz
Ebenso wie die Energie bleibt auch die Masse bei einer chemischen Reaktion erhalten. Dies wird Massenerhaltungssatz genannt. Masse kann also weder erschaffen noch zerstört werden. Bezogen auf eine chemische Reaktion bedeutet das: Es liegen vor und nach der Reaktion die gleiche Anzahl an gleichartigen Atomen vor. Nur die Bindungsverhältnisse ändern sich. Die Atome werden also auf eine andere Art verknüpft, sind aber in den Produkten immer noch vorhanden. Darum ist es wichtig, eine Reaktionsgleichung richtig ausgleichen zu können.
Nehmen wir das Beispiel der Reaktion von Aluminium und Sauerstoff zu Aluminiumoxid:
$Al + O_2 \longrightarrow~Al_2O_3$.
Wenn du die einzelnen Atome zählst, wirst du feststellen, dass nicht auf beiden Seiten die gleiche Anzahl vorliegt. Es muss also ausgeglichen werden. Im Aluminiumoxid liegen 3 Atome Sauerstoff vor. Im Sauerstoffmolekül befinden sich 2 Atome Sauerstoff. Das kleinste gemeinsame Vielfache ist 6. Vor Sauerstoff wird daher eine 3 und vor das Aluminiumoxid eine 2 geschrieben. Nun muss noch Aluminium ausgeglichen werden. Auf der Produktseite befinden sich nun 4 Aluminium-Atome. Daher werden 4 Aluminium-Atome auf der Eduktseite benötigt. Es ergibt sich folgende Gleichung:
$4~Al + 3~O_2 \longrightarrow~2~Al_2O_3$.
Alle Videos zum Thema
Videos zum Thema
Chemische Formeln und Reaktionen (10 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Chemische Formeln und Reaktionen (9 Arbeitsblätter)
-
 Namen und Symbole chemischer Elemente
PDF anzeigen
Namen und Symbole chemischer Elemente
PDF anzeigen -
 Was ist eine chemische Reaktion?
PDF anzeigen
Was ist eine chemische Reaktion?
PDF anzeigen -
 Chemische Reaktionen und ihre Merkmale
PDF anzeigen
Chemische Reaktionen und ihre Merkmale
PDF anzeigen -
 Aufstellen einer Reaktionsgleichung
PDF anzeigen
Aufstellen einer Reaktionsgleichung
PDF anzeigen -
 Stöchiometrie – Ausgleichen von Reaktionsgleichungen
PDF anzeigen
Stöchiometrie – Ausgleichen von Reaktionsgleichungen
PDF anzeigen -
 Aufstellen einer Summenformel
PDF anzeigen
Aufstellen einer Summenformel
PDF anzeigen -
 Gesetz von der Erhaltung der Masse
PDF anzeigen
Gesetz von der Erhaltung der Masse
PDF anzeigen -
 Energieerhaltungssatz
PDF anzeigen
Energieerhaltungssatz
PDF anzeigen -
 Wortgleichungen erstellen
PDF anzeigen
Wortgleichungen erstellen
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff























