Freiwillige Redoxprozesse und Elektrolyse
Einfach lernen mit Videos, Übungen, Aufgaben & Arbeitsblättern
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Redoxreaktionen
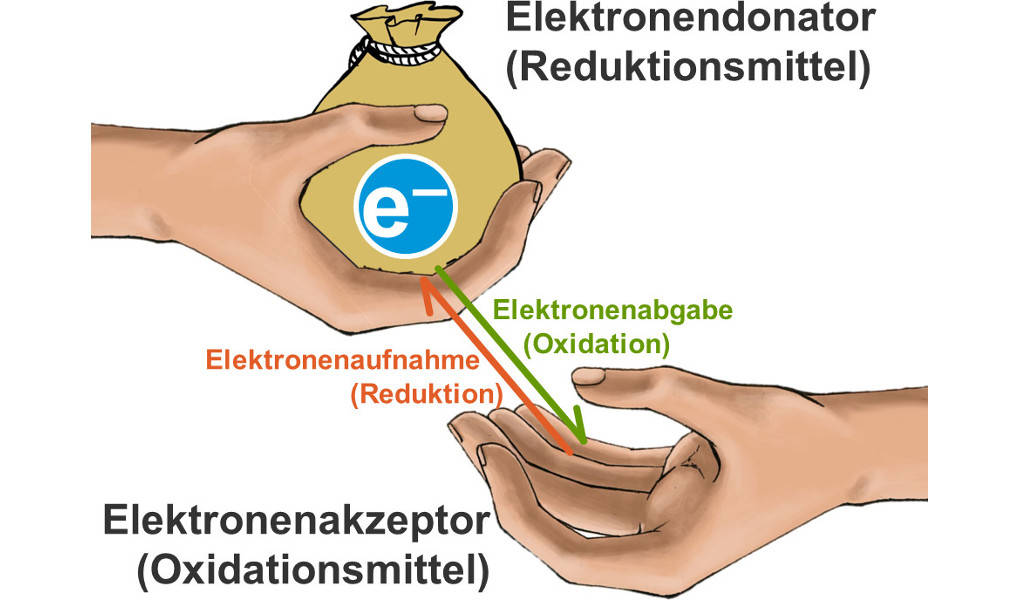
Eine Redoxreaktion besteht aus zwei Teilen, der Oxidation, das ist der Vorgang der Elektronenabgabe, und der Reduktion, der Vorgang der Elektronenaufnahme. Eine Redoxreaktion ist also eine Reaktion mit Elektronenübergang.
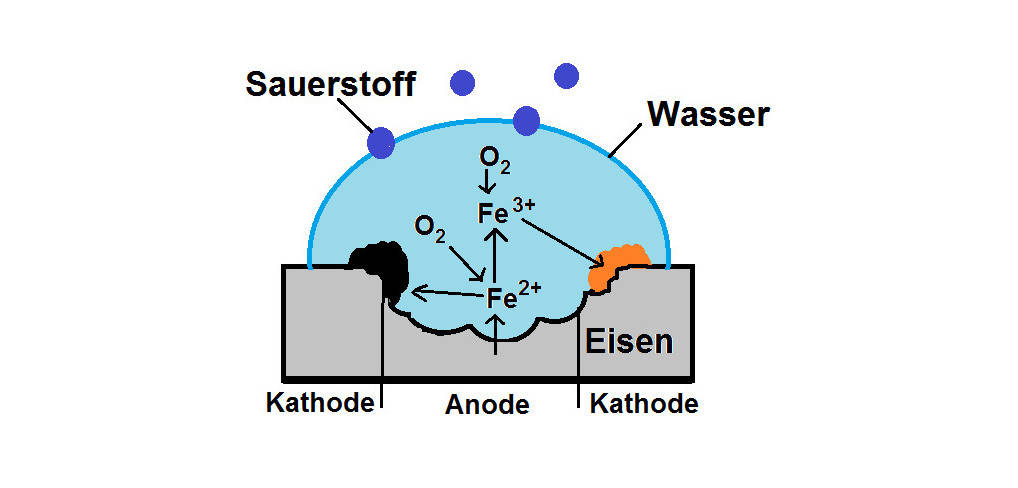
In der Umwelt laufen ständig Redoxreaktionen ab. Die Korrosion von Eisen, also das Rosten, ist so ein Vorgang. Dies kann entweder als chemische oder elektrochemische Korrosion ablaufen. Bei der letzteren Variante sind ein Elektrolyt, wie z.B. Wasser, und Sauerstoff beteiligt. Durch die Oxidation des Eisens zu Eisen(III)-Ionen $(Fe^{3+})$ und die Reduktion von Sauerstoff entsteht über mehrere Schritte Rost. Chemisch betrachtet ist Rost die Verbindung Eisenoxidhydroxid $(FeO(OH))$.
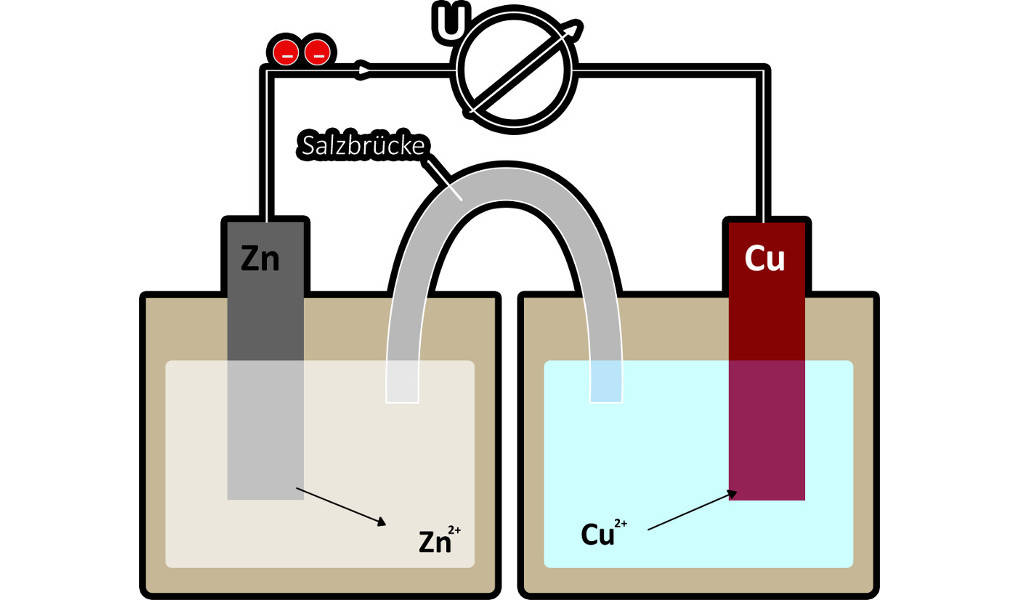
Redoxreaktionen können genutzt werden, um elektrischen Strom zu erzeugen. Jede Batterie beruht auf dem Prinzip der galvanischen Zelle. Mit ihrer Hilfe kann chemische Energie in elektrische umgewandelt werden. Ein Beispiel für eine galvanische Zelle ist das Daniell-Element.
Elektrolyse
Der Begriff Elektrolyse bezeichnet eine Redoxreaktion, die durch das Anlegen einer elektrischen Spannung erzwungen wird. Man kann sie als die Umkehrreaktion der galvanischen Zelle bezeichnen. Es wird also elektrische Energie in chemische umgewandelt. Dieser Vorgang läuft zum Beispiel ab, wenn du einen Akku auflädst.
Am Beispiel des Daniell-Elements kann es deutlich gemacht werden. Wenn man eine Spannung anlegt, kehrt sich die Reaktion um. Das bedeutet, dass Anode und Kathode ihren Platz tauschen. Die Anode ist immer der Ort der Oxidation und die Kathode der Ort der Reduktion. Es wird nun also das edlere Metall (Kupfer) oxidiert und das unedlere Metall (Zink) reduziert. Für diese Vorgänge kann man Reaktionsgleichungen aufstellen.
Oxidation: $Cu \longrightarrow~Cu^{2+} + 2~e^-$ Reduktion: $Zn^{2+} + 2~e^- \longrightarrow~Zn$
Anwendungen der Elektrolyse
Mithilfe der Elektrolyse lassen sich einige Stoffe gewinnen, deren Herstellung ansonsten sehr teuer oder gar unmöglich wäre. So lassen sich Metalle wie Zink, Natrium oder Lithium durch die Elektrolyse ihrer Salze gewinnen. Auch die Erzeugung von Gasen wie Wasserstoff und Chlor beruht auf der Elektrolyse.
Die Elektrolyse wird auch genutzt, um metallische Überzüge zu erzeugen. Dieser Vorgang wird paradoxerweise als Galvanisieren bezeichnet. Dabei wird das Metall, welches den Überzug bilden soll, als Anode geschaltet. Es wird also oxidiert. Das Werkstück, das den Überzug erhalten soll, bildet die Kathode. Beide Elektroden befinden sich in derselben Lösung aus Ionen des Überzugmetalls. Diese Ionen scheiden sich dann an dem Werkstück ab und bilden den gewünschten Metallüberzug. Die Stärke dieser Schicht kann man durch die Zeit im elektrolytischen Bad und die Menge des Stroms beeinflussen. Dieser Vorgang wird z.B. zum Verchromen von Armaturen und Vergolden von Schmuckgegenständen genutzt.

Eine weitere Anwendung der Elektrolyse ist das Eloxalverfahren. Dabei wird Aluminium durch Elektrolyse absichtlich an der Oberfläche oxidiert. Es handelt sich also um eine elektrolytische Oxidation von Aluminium (Eloxal). Daher leitet sich auch der Name des Verfahrens ab.
Wie ist die Reaktion von Aluminium und Säuren? Aluminium verhält sich bei der Korrosion anders als Eisen. Rost ist porös und durchlässig für Wasser und Sauerstoff. Das Produkt der Oxidation von Aluminium $(Al_2O_3)$ ist dies nicht. Die Korrosion bildet hier eine sogenannte Passivierungsschicht. Diese verhindert eine weitere Korrosion des darunter liegenden Aluminiums. Durch das Eloxalverfahren wird so eine starke Schutzschicht gebildet, die die Korrosion von Bauteilen aus Aluminium z.B. in der Bauindustrie oder im Automobilbau verhindern soll.

Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Freiwillige Redoxprozesse und Elektrolyse (8 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Freiwillige Redoxprozesse und Elektrolyse (5 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff













 Die Elektrolyse
Die Elektrolyse
 Elektrolyse – erzwungene Redoxreaktionen
Elektrolyse – erzwungene Redoxreaktionen
 Korrosion von Metallen
Korrosion von Metallen
 Korrosion – Schutzmaßnahmen
Korrosion – Schutzmaßnahmen
 Technische Elektrolysen am Beispiel der Zementation
Technische Elektrolysen am Beispiel der Zementation









